Kekhasan atom karbon
Nama : Desi Amalia, S.Pd
Mata Pelajaran : Kimia
Kelas : XI IPA 3 dan XI IPA 5, XI IPA 2
Kode KD : 3.1 Menganalisis struktur dan sifat senyawa hidrokarbon berdasarkan pemahaman kekhasan atom karbon dan penggolongan senyawanya.
Materi : Senyawa Hidrokarbon
Tujuan Pembelajaran : Melalui pembelajaran dengan menggunakan model Problem Based Learning, peserta didik diharapkan mampu Mengidentifikasi unsur C, H dan O di dalam senyawa karbon, Mendeskripsikan kekhasan atom karbon, Menjelaskan pembentukan ikatan karbon, dan Menentukan atom C primer, sekunder, tersier dan kuarterner di dalam senyawa karbon dengan teliti dan tepat,serta menyelesaikan masalah kontekstual terkait dengan senyawa karbon yang sering ditemukan didalam kehidupan sehari-hari dengan aktif, toleran dan bekerjasama dalam kelompok.
Assalamualaikum Wr WB ..
Haiii anak-anak soleh solehah kelas XI IPA 2, XI IPA 3,XI IPA 5, bagaimana kabarnya hari ini anak-anak? Tak terasa ya kalian telah menduduki bangku kelas XI ,bagaimana perasaan nya nak? sungguh happy pastinya yaa... tapi ingat di bangku kelas XI ini materi-materi pelajaran akan lebih semakin padat lagi ya... jadi harus banyak rajin membaca buku pelajaran , ataupun sumber yang lain..dan tentunya banyak mengerjakan latihan-latihan soal dirumah..
Baiklah, sebelum kita memasuki materi pelajaran hari ini.. ada baiknya kita kenalan dulu ya, karena ibu belum pernah mengajar di kelas Kalian, jadi kita saling kenalan dulu yuk...😍
Adapun langkah-langkah pembelajaran kita hari ini adalah :
1.absensi di dalam kelas.
2.Buka blogger ibu, dan Silahkan pahami kompetensi dasar dan tujuan pembelajaran pada materi hari ini
3. sebagai tambahan materi di dalam kelas, silahkan kalian juga baca dan pahami materi dibawah ini
Kalau ngomongin soal persamaan ciri-ciri makhluk hidup, biasanya sih, banyak yang langsung inget pelajaran Biologi.
Dari pelajaran tersebut kalian bisa mengenal persamaan ciri makhluk hidup, seperti memiliki kemampuan bereproduksi, membutuhkan energi, mengalami pertumbuhan, dan lain sebagainya.
Namun, persamaan antar makhluk hidup juga bisa kalian dapatkan di dalam pelajaran kimia, lho. Apa tuh, persamaannya?
Semua makhluk hidup membutuhkan satu unsur kimia organik yang sama, yaitu atom karbon (C).
Melansir laporan dari Encyclopedia Britannica (2022), mulai dari makhluk hidup yang berukuran mikroskopik seperti bakteri hingga yang berukuran raksasa seperti ikan paus biru atau dinosaurus, tubuhnya tersusun dari atom karbon.
Manusia juga termasuk makhluk hidup yang tersusun dari atom karbon, Bahkan, karbon menjadi elemen penyusun tubuh kita kedua paling banyak dengan persentase sebesar 18,5% setelah oksigen dengan persentase 65%.
Dengan adanya karbon dalam tubuh makhluk hidup, para arkeolog pun jadi bisa mengetahui usia fosil-fosil yang terkubur di bumi menggunakan teknik yang disebut penanggalan radiokarbon.
Kok bisa ya, karbon jadi unsur kimia yang dimiliki semua makhluk hidup? Ternyata, hal itu dimungkinakn karena atom karbon mempunya kekhasan dibandingkan atom-atom yang lainnya.
Apa sih, kekhasan atom karbon itu?
Yuk, simak artikel ini untuk dapetin penjelasannya!
Kekhasan Atom Karbon
Tiga contoh sifat kekhasan atom karbon adalah dapat membentuk 4 ikatan kovalen, memiliki ukuran jari-jari orbit yang kecil, dan dapat membentuk rantai ikatan dengan atom karbon lainnya.
Untuk lebih jelasnya, berikut penjelasan tentang ketiga sifat kekhasan atom karbon tersebut.
1. Dapat Membentuk 4 Ikatan Kovalen

Seperti yang mungkin kalian sudah ketahui, atom karbon adalah atom yang memiliki nomor atom enam. Masih inget nggak nih, nomor atom itu menyatakan apa?
Yup! Karena atom itu bersifat netral, maka nomor atomnya menyatakan jumlah proton yang sama dengan jumlah elektronnya.
Dari nomor atom karbon kita pun jadi tahu kalau, atom tersebut memiliki 6 buah elektron.
Kalau ditulis dalam konfigurasi elektron, jadi seperti di bawah ini.
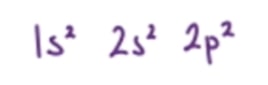
Dari konfigurasi elektron di atas, kita jadi tahu nih, kalau elektron atom karbon itu menempati 2 kulit. Dengan jumlah elektron valensi atau elektron pada kulit terluarnya sebanyak empat elektron.
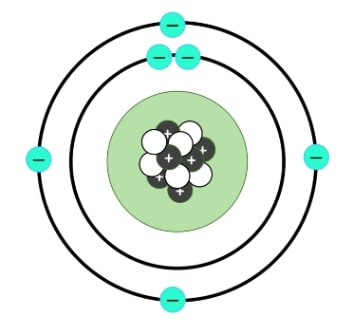
Oke. Jumlah empat elektron valensi ini spesial karena artinya atom karbon mempunyai kekhasan dapat membentuk empat ikatan kovalen untuk mencapai keadaan stabil yang menyerupai gas mulia.
Eits, sebelum lanjut, mungkin masih ada yang mau nanya nih. Apa itu ikatan kovalen?
Ikatan kovalen adalah ikatan yang terbentuk antara dua atom atau lebih dengan cara pemakaian elektron bersama.
Nah, lanjut ya. Atom karbon sendiri membentuk ikatan kovalen ini untuk mencapai keadaan stabil di mana sebuah atom memiliki 8 elektron valensi supaya menyerupai kestabilan gas mulia, sesuai Teori Kossel.
Contoh ikatan kovalen karbon yang paling umum adalah dengan atom hidrogen seperti ini.
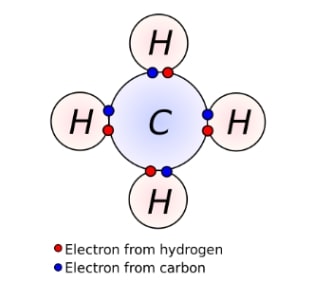
Dengan melakukan ikatan kovalen dengan hidrogen, elektron valensi karbon pun tidak lagi berjumlah empat melainkan delapan.
Nah, bisa membentuk empat ikatan kovalen ternyata hal yang unik. Kok, gitu? Karena atom lainnya tidak bisa membentuk ikatan kovalen sebanyak itu. Kalaupun ada yang bisa membentuk 5 ikatan kovalen, jumlah elektron valensinya pun akan lebih dari 8 dan malah jadi nggak stabil. ( COBA INGAT TENTANG MATERI IKATAN KIMIA YA )
2. Jari-Jari Orbitnya Berukuran Kecil
Ukuran jari-jari orbit sebuah atom ternyata berpengaruh dengan kemampuannya membentuk ikatan kovalen dengan atom lain, lho. Karena, semakin besar ukurannya semakin jauh juga jarak orbital atomnya.
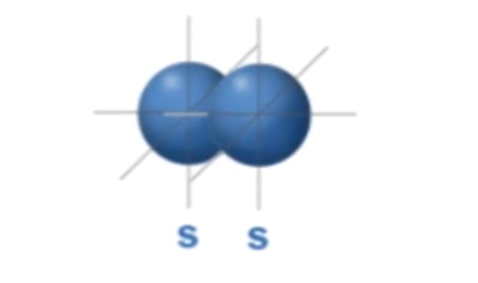
Alhasil, orbital akan sulit untuk membentuk ikatan kovalen yang dilakukan dengan overlapping atau tumpang tindih dengan orbital atom lain dan hanya bisa membentuk satu jenis ikatan kovalen saja, yaitu ikatan tunggal.
Contohnya adalah seperti ikatan antar atom hidrogen (H–H) di orbital s. Atom ini hanya bisa membentuk ikatan tunggal saja, karena jarak antar sisi orbital yang jauh menyebabkan hanya satu sisi saja yang bisa bertumpang tindih.
Nah, karena atom karbon itu berukuran kecil. Atom karbon itu bisa membentuk tidak hanya ikatan kovalen tunggal, tapi bisa juga ikatan kovalen rangkap dua dan rangkap tiga.
Kalau digambarkan bagaimana orbital p atom karbon tumpang tindih dengan orbital p atom lainnya akan terlihat seperti di bawah ini.
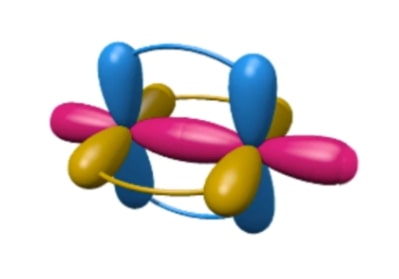
Selain dapat membentuk berbagai jenis ikatan kovalen, ukuran atom karbon yang kecil pun membuatnya mudah untuk membuat ikatan dengan atom-atom lainnya yang berukuran lebih besar.
Contoh kekhasan atom karbon ini adalah dapat berikatan dengan atom hidrogen membentuk senyawa hidrokarbon.
Kemampuan atom ini untuk membentuk senyawa baru dengan atom-atom lainnya membuat unsur karbon hampir dapat kita jumpai di setiap benda yang kita temui sehari-hari, dari pensil hingga berlian.
Dan, walaupun karbon yang dalam Bahasa Latin artinya adalah arang itu aslinya memiliki pigmen berwarna hitam, makhluk hidup yang tersusun dari atom ini tidak ikutan berwarna hitam.
3. Dapat Berikatan dengan Atom Karbon Lainnya
Sifat kekhasan atom karbon selanjutnya adalah antara karbon satu dan lainnya bisa membentuk suatu rantai. Menurut laporan dari ToughtCo. (2019), kekhasan atom karbon inipun membuat karbon dijuluki sebagai “rajanya elemen”.
Karena memiliki kemampuan membentuk ikatan atau rantai dengan baik atom lain maupun atom karbon lainnya,atom karbon bisa punya lebih dari 10 juta senyawa baru.
Rantai karbon sendiri ada dua macam, yakni rantai lurus dan rantai cabang, Kalian bisa lihat pada gambar pembentukan senyawa hidrokarbon di bawah ini. Gambar bagian atas adalah contoh rantai tunggal, dan bagian bawah merupakan jenis rantai yang bercabang.
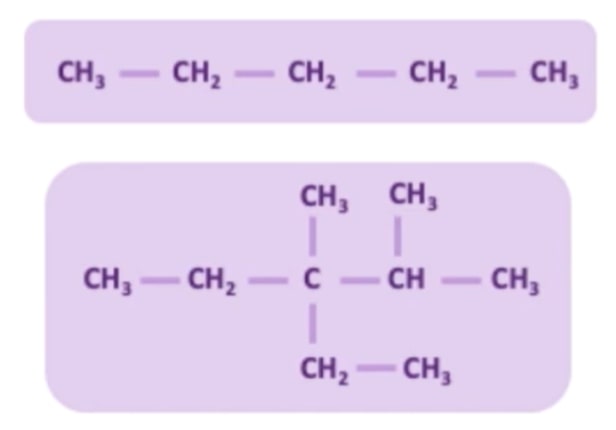
Lalu, karena atom karbon dapat membentuk rantai dengan atom karbon lainnya, ada penamaan khusus untuk atom karbon di dalam rantai tersebut. Penamaanya terbagi menjadi empat, yaitu C primer (1*), C sekunder (2*), C tersier (3*), dan C kuartener (4*).
| Nama | Arti |
| C primer (1*) | Atom karbon hanya mengikat 1 atom karbon lainnya. |
| C sekunder (2*) | Atom karbon mengikat 2 atom karbon lainnya. |
| C tersier (3*) | Atom karbon mengikat 3 atom karbon lainnya. |
| C kuartener (4*) | Atom karbon mengikat 4 atom karbon lainnya. |
Nah, kekhasan atom karbon yang dapat membentuk berbagai jenis ikatan kovalen di poin sebelumnya tadi menghasilkan dua jenis rantai karbon yang berbeda,
Ketika semua ikatan antar karbonnya berupa ikatan tunggal, maka disebut dengan rantai ikatan jenuh. Sedangkan, kalau ada satu saja ikatan antar karbon yang berbentuk rangkap dua atau rangkap tiga, rantainya merupakan rantai ikatan tak jenuh.
Kenapa sih, ikatan tunggal disebut jenuh dan yang rangkap tak jenuh?
Kalau kalian cermati ilustrasi di atas, pada ikatan tunggal keempat elektron valensi karbon sudah mengikat elektron valensi dari atom lainnya. Kalo ibarat tangan nih, keempat tangannya sudah menggandeng empat orang yang berbeda.
Oleh karena itu dia disebut jenuh, sudah nggak bisa ditambah lagi.
Sedangkan, kalau ikatan kovalen rangkap, mereka dua atau tiga tangannya kemungkinan masih menggandeng orang yang sama. Jadi, salah satu gandengannya masih bisa diputus dan diberi pasangan baru.
Itu kenapa, kalau dalam rantai karbon ada ikatan rangkap, rantai itu disebut ikatan tak jenuh. Karena, belum mencapai batas maksimum ikatannya.
Nah, sifat kekhasan atom karbon yang dapat membentuk rantai dengan atom karbon lainnya ini juga membuat dirinya bisa membentuk alotrop karbon, lalu Apa sih, alotrop karbon itu?
Alotrop karbon adalah keberadaan unsur yang sama dalam dua bentuk struktur yang berbeda. Nah, struktur yang berbeda ini yang memungkinakan atom karbon membentuk benda yang berbeda dan ciri-ciri yang berbeda juga.
Contohnya adalah berlian dan grafit dalam pensil. Berlian itu merupakan zat bentukan karbon yang paling keras, dan grafit yang paling lembut.
nah inilah beberapa ciri khas dari atom karbon , kalian bisa cari lagi apa saja yang termasuk dalam kekhasan atom karbon yaa..
4. Agar lebih jelas, di akhir pertemuan kita coba latihan ya nak !
Soal Post test :
- Berikut ini yang bukan merupakan kekhasan atom karbon adalah ….
A. disebut rantai karbon jenuh ketika terdapat ikatan rangkap di dalamnya
B. dapat membentuk maksimal 4 ikatan kovalen
C. dapat membentuk ikatan kovalen rangkap
D. ikatan kovalen yang terbentuk sangat kuat karena jari-jari atom karbon tergolong kecil
E. dapat membentuk rantai hidrokarbon lurus maupun bercabang
2. Berikut ini penjelasan yang kurang tepat mengenai posisi atom C dalam rantai karbon yaitu ….
A. jika suatu atom C mengikat 1 atom C lain dan 3 atom H, maka atom C ini merupakan atom C primer
B. jika suatu atom C mengikat 2 atom C lain dan 2 atom H, maka atom C ini merupakan atom C sekunder
C. jika suatu atom C mengikat 3 atom C lain dan 1 atom H, maka atom C ini merupakan atom C tersier
D. jika suatu atom C mengikat 2 atom C lain, 1 atom O, dan 1 atom H, maka atom C ini merupakan atom C tersier
E. jika suatu atom C semua tangannya mengikat 4 atom C lain maka atom C ini merupakan atom C kuartener
Demikian lah pembelajaran kita hari ini, tetap semangat ya nak....



Komentar
Posting Komentar