Larutan elektrolit dan non elektrolit serta derajat ionisasi nya
Materi : Daya Hantar Listrik Larutan
Kelas : X IPA 4
Jumlah Pertemuan : 1x Pertemuan
Tanggal : 12 Januari 2021
Assalamualaikum Wr WB..
Halo semuanya anak-anak kelas X IPA 4 yang Soleh dan Solehah..hari ini kita sudah masuk pertemuan kedua ya..tetap semangat buat kalian semua di semester genap ini..
Diminggu kemarin kalian sudah membuat peta konsep tentang larutan, sehingga kalian sudah mengerti dan memahami pengertian dan perbedaan tentang larutan elektrolit dan non elektrolit, sehingga kalian juga sudah mengetahui contoh² yg mana larutan elektrolit dan non elektrolit.
Nah untuk hari ini,tujuan pembelajaran yang harus kalian capai adalah :
1. Siswa dapat menjelaskan penyebab kemampuan larutan elektrolit dapat menghantarkan arus listrik,
2. Siswa dapat menjelaskan bahwa larutan elektrolit dapat berupa senyawa ion dan Kovalen polar.
Maka dari itu yuk sebelumnya kita simak materi dibawah ini..
Elektrolit Senyawa Ion dan Kovalen
Berdasarkan dari terbentuknya ikatan ion dalam larutan, senyawa yang termasuk elektrolit adalah senyawa ion dan kovalen polar, sedang untuk senyawa yang termasuk non elektrolit adalah senyawa yang ikatan nya terbentuk dari senyawa kovalen non polar.
Senyawa Ion
Sesuai namanya, senyawa ini terdiri dari ion-ion yang bergerak bebas dalam pelarutnya, contohnya larutan NaCl, dimana terdiri dari ion Na+ dan ion Cl–. senyawa NaCl hanya dapat menghantarkan listrik jika dilarutkan atau dilelehkan, sementara jika dalam bentuk kristal atau padatan, NaCl tidak dapat menghantarkan listrik, karena ion tidak dapat bergerak bebas.
Senyawa Kovalen Polar
Senyawa kovalen bersifat polar apabila dilarutkan kedalam air, karena air merupakan pelarut polar. Antara molekul air dan molekul zat terlarut akan terjadi tarik menarik yang cukup kuat untuk memutuskan ikatan-ikatan molekul tertentu, dan membentuk ion. Sehingga dapat disimpulkan hanya senyawa kovalen polar yang dalam bentuk larutan saja yang dapat menghantarkan listrik, sedangkan yang berbentuk lelehan dan padatan tidak dapat menghantarkan listrik. Contoh larutan yang termasuk dalam senyawa kovalen polar adalah larutan HCl atau yang biasa disebut larutan asam klorida.
Untuk mempermudah kalian mengingat dan memahaminya, kalian bisa tabel dibawah ini, perbedaan elektrolit pada senyawa ion, kovalen polar, dan kovalen non polar.
| Jenis Senyawa | Padatan | Lelehan | Larutan |
| Ion | Isolator | Konduktor | Konduktor |
| Kovalen Polar | Isolator | Isolator | Konduktor |
| Kovalen Non Polar | Isolator | Isolator | Isolator |
Derajat Ionisasi
Derajat ionisasi adalah parameter larutan elektrolit yang berupa perbandingan antara jumlah zat yang mengion dengan jumlah zat mula-mula, oleh karena itu digunakan persamaan sebagai berikut
Dimana, 𝛂 = derajat ionisasi.
Dengan ketentuan sebagai berikut,
- 𝛂=1, maka zat mengalami ionisasi sempurna, atau dapat digolongkan asam atau basa kuat.
- 0<𝛂<1, maka zat mengalami ionisasi sebagian, atau dapat digolongkan asam atau basa lemah.
- 𝛂=0, maka tidak mengalami ionisasi sama sekali.
Penerapan Larutan Elektrolit
Meskipun rasanya terdengar cukup asing di telinga kita, dan jarang dipakai dalam komunikasi sehari-hari, sebenarnya manfaat dari larutan elektrolit maupun non elektrolit banyak diterapkan dalam kehidupan sehari-hari loh guys, salah satunya larutan elektrolit bagi tubuh manusia.
Kalian pernah mengalami dehidrasi? Dehidrasi adalah keadaan dimana tubuh kita kekurangan cairan, maka kita diperlukan untuk mengonsumsi cairan atau larutan oralit. Cairan oralit sendiri terdiri dari air, gula, dan garam, dan biasa dikonsumsi untuk mencegah dehidrasi pada orang yang sedang diare dan muntah. Tidak hanya itu, larutan elektrolit juga berguna terkait dengan metabolisme tubuh, seperti sebagai ion pengaktif enzim, melancarkan impuls pada saraf, dan lain-lain.
Selain itu, larutan elektrolit juga banyak digunakan atau diterapkan untuk sel elektrokimia seperti bahan pengisi aki, baterai, dan lain-lain.
Oke untuk hari ini juga kita akan mengadakan virtual lab tentang daya hantar listrik larutan ya nak, jadi walau kalian ada dirumah kalian tetap bisa melakukan praktikum.
Silahkan kalian buka link berikut ini
: https://vlab.belajar.kemdikbud.go.id/Experiments/virtuallab-solventconductivity/#/
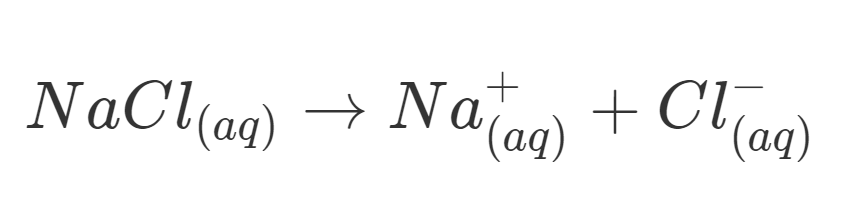
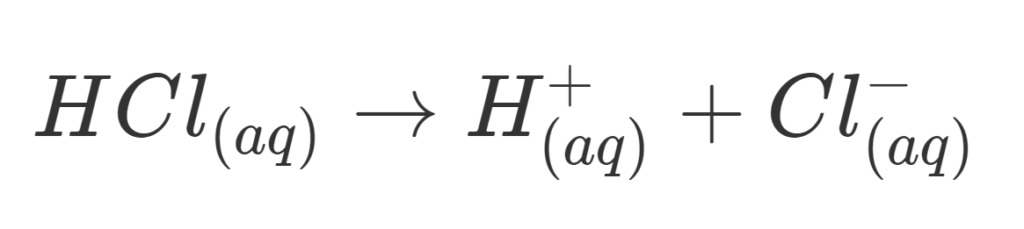
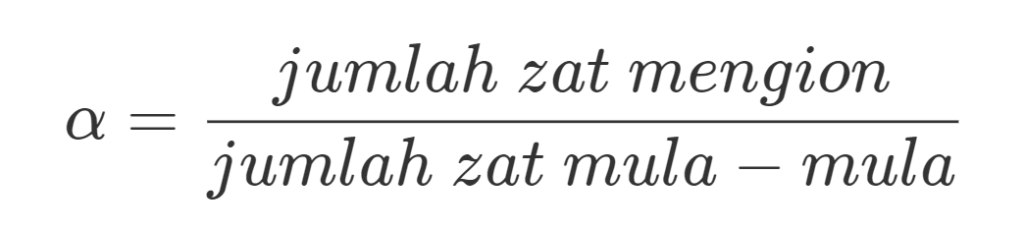

Sabrina Chantika Putri
BalasHapusX IPA 4
Angken Kesuma Dewi
BalasHapusX IPA 4
Joko Prayogo
BalasHapusX IPA 4
Ambun putri qatrunada
BalasHapusX IPA 4
Nurul Ismania
BalasHapusXIPA4
Tiffany Wahdamevia
BalasHapusX IPA 4
Qinthara Farrasalya D
BalasHapusX Ipa 4
Yulia kamila
BalasHapusX ipa 4
Andini Rahma Kemala
BalasHapusX IPA 4
Bulan Nabila Maharani
BalasHapusX IPA 4
Jihan Mutia A.
BalasHapusX IPA 4
Calista Manda Widyapalastri
BalasHapusX IPA 4
Nazwa andini
BalasHapusX ipa 4
Nadira isaura
BalasHapusX ipa 4
Delta Atita
BalasHapusX IPA 4
Dandi Junaedi
BalasHapusX IPA 4
Najwa Syahirah R.
BalasHapusX IPA 4
Tri Febrianto
BalasHapusX IPA 4
Alifia zahrah bilqis v
BalasHapusX ipa4
Artika zahra a.s
BalasHapusX ipa 4
Elisa anggraini
BalasHapusX IPA 4
Muhammad Rizki Maulana X IPA 4
BalasHapusJernicho alvindo x IPA 4
BalasHapusMicha Damayanti
BalasHapusX IPA 4
Zeki Dimas Saputra
BalasHapusX IPA 4
Hani Gita Salsabila
BalasHapusX IPA 4
Adhitya septian nugroho
BalasHapusXipa4
Noval bagas satria
BalasHapusXipa4