Pengaruh pH terhadap kelarutan
Materi : Kelarutan dan Hasil kali kelarutan
Kelas : XI ipa 2 dan 3
Jumlah pertemuan : 1x pertemuan
Tanggal : 28 April 2020
Pengaruh pH terhadap Kelarutan
Tingkat keasaman larutan (pH) dapat mempengaruhi kelarutan dari berbagai jenis zat, terutama senyawa hidroksida dan garam dari asam lemah yang sukar larut. Untuk lebih jelasnya, perhatikan kedua contoh berikut.
1. pH dan kelarutan senyawa hidroksida
Mg(OH)2(s) ⇌ Mg2+(aq) + 2OH−(aq) Ksp = 1,8 × 10−11
Larutan jenuh Mg(OH)2 memiliki pH = 10,52 dengan kelarutannya 1,7 × 10−4 mol/L.

Bila Mg(OH)2 dilarutkan dalam larutan buffer dengan pH = 9,0, maka pOH = 5,0 dan [OH−] = 1,0 × 10−5, maka melalui perhitungan persamaan tetapan kesetimbangan kelarutan Mg(OH)2 diperoleh:

Kelarutan Mg(OH)2 dalam larutan buffer pH 9,0 adalah 0,18 mol/L. Hal ini menunjukkan bahwa kelarutan Mg(OH)2 meningkat seiring dengan penurunan pH larutan.
Secara umum, jika pH mengalami penurunan, maka kelarutan senyawa hidroksida akan meningkat.
2. pH dan kelarutan garam dari asam lemah
Kelarutan PbF2 juga meningkat seiring bertambahnya keasaman larutan. Hal ini dikarenakan anion F− bersifat basa (F− adalah basa konjugasi dari asam lemah HF). Oleh karena itu, kesetimbangan kelarutan PbF2 bergeser ke kanan berhubung konsentrasi F− berkurang seiring protonasi membentuk HF.
PbF2(s) ⇌ Pb2+(aq) + 2F−(aq)
F−(aq) + H+(aq) ⇌ HF(aq)
F−(aq) + H+(aq) ⇌ HF(aq)
Persamaan reaksi kesetimbangan keseluruhan untuk kedua reaksi tersebut, yaitu:
PbF2(s) + 2H+(aq) ⇌ Pb2+(aq) + 2HF(aq)
Garam lainnya dengan anion seperti CO32−, PO43−, CN−, dan S2− juga memiliki kecenderungan yang sama. Secara umum, jika pH mengalami penurunan, maka kelarutan garam dari asam lemah akan meningkat.




![Q = [Ca^{2+}][F^-]^2 Q = [Ca^{2+}][F^-]^2](https://s0.wp.com/latex.php?latex=Q+%3D+%5BCa%5E%7B2%2B%7D%5D%5BF%5E-%5D%5E2&bg=f9f9f9&fg=000000&s=0)
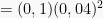

Contoh Soal Kelarutan dan Hasil Kali Kelarutan (KSP) dan Pembahasan
Contoh Soal 1:
Hitunglah kelarutan Cu(OH)2 dalam satuan g/L, jika diketahui Ksp Cu(OH)2 = 2,2 × 10−20.
Pembahasan:


Contoh Soal 2:
Hitunglah kelarutan molar PbI2 dalam larutan KI 0,1 M. (Ksp PbI2 = 7,1 × 10−9)
Pembahasan:
Dalam larutan, KI akan terdisosiasi menjadi ion K+ dan ion I−. Pada larutan KI 0,1 M, [I−] = 0,1 M. Asumsikan s adalah jumlah mol PbI2 yang larut menghasilkan 1 L larutan jenuh, sehingga terdapat tambahan s mol Pb2+/L dan 2s mol I−/L.
PbI2(s) ⇌ Pb2+(aq) + 2I−(aq)

Oleh karena dapat diduga bahwa s ≪ 0,1, maka dapat diasumsikan (0,1 + 2s) ≈ 0,1.

Jadi, kelarutan molar PbI2 dalam larutan KI 0,1 M adalah 7,1 × 10−7 mol/L.
Contoh Soal 3:
Sebanyak 100 mL Ca(NO3)2 0,3 M dicampurkan dengan 200 mL larutan NaF 0,06 M. Jika Ksp CaF2 = 3,2 × 10−11, apakah akan terbentuk endapan CaF2?
Pembahasan:
Untuk mengetahui terbentuk atau tidaknya endapan CaF2, kita perlu membandingkan nilai Q terhadap Ksp CaF2. Sebelum menentukan nilai Q, kita perlu mencari konsentrasi ion Ca2+ dan ion F− dalam campuran terlebih dahulu.
Dalam 100 mL Ca(NO3)2 0,3 M, jumlah mol Ca(NO3)2 = (0,3 mol/L)(0,1 L) = 0,03 mol
Dalam 200 mL NaF 0,06 M, jumlah mol NaF = (0,06 mol/L)(0,2 L) = 0,012 mol
Ca(NO3)2(aq) → Ca2+(aq) + 2NO3−(aq)
0,03 mol 0,03 mol 0,06 mol
NaF(aq) → Na+(aq) + F−(aq)
0,012 mol 0,012 mol 0,012 mol
0,03 mol 0,03 mol 0,06 mol
NaF(aq) → Na+(aq) + F−(aq)
0,012 mol 0,012 mol 0,012 mol
Setelah pencampuran, [Ca2+] = 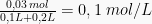 dan [F−] =
dan [F−] = 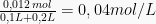 .
.
Karena Q > Ksp, setelah pencampuran terbentuk endapan CaF2.
Komentar
Posting Komentar