Bilangan Kuantum
1. Identitas :
- Nama Guru : Desi Amalia, S. Pd, Gr.
- Mata Pelajaran : Kimia
- Kelas : X. 8 dan X. 9
- Pertemuan : Minggu ke 19
- menentukan konfigurasi elektron menurut model atom Bohr melalui tabel data beberapa unsur.
- menentukan konfigurasi elektron menurut model atom kuantum melalui tabel data beberapa unsur.
- Materi :
KONFIGURASI ELEKTRON
Dari konfigurasi elektron pula, dapat diketahui golongan dan periode dari suatu atom.
Golongan ditunjukkan oleh jumlah elektron terluar (elektron valensi) sedangkan periode ditunjukkan oleh nomor kulit terbesar yang terisi elektron (kulit terluar).
2. Konfigurasi Elektron Menurut Model Atom Mekanika Kuantum
Menurut model atom mekanika kuantum, elektron–elektron dalam atom bergerak mengelilingi inti pada tingkat–tingkat energi tertentu (kulit atom). Pada setiap kulit atom terdiri atas subkulit yang merupakan kumpulan orbital (tempat kebolehjadian ditemukan adanya elektron).
a. Bentuk Orbital Berikut adalah bentuk-bentuk orbital:
1) Orbital s Orbital s berbentuk seperti bola di sekitar inti atom. Ketika tingkat energi elektron meningkat, maka bentuk orbitalnya semakin besar.
Gambar 3. Bentuk Orbital s (sumber: https://www.kimia-science7.com)
2) Orbital p Orbital p berbentuk seperti bola terpilin dan menunjuk ke sumbu-sumbu ruang tertentu. Orbital yang berada pada sumbu X maka disebut Px, orbital yang berada pada sumbu Y maka disebut Py, orbital yang berada pada sumbu Z maka disebut Pz.
Gambar 4. Bentuk Orbital p (sumber: https://www.kimia-science7.com)
3) Orbital d
Orbital d berbentuk seperti bola terpilin. Ada 5 orbital subkulit d, yaitu dx-y, dy- z, dx-z, dx2-y2, dz2. Tiga orbital d terletak diantara sumbu ruang dan 2 orbital d terletak pada sumbu ruang. Orbital dx-y berada diantara sumbu X dan Y, orbital dy-z berada diantara sumbu Y dan Z, orbital dx-z berada diantara sumbu X dan Z, orbital dx2-y2 berada pada sumbu X dan Y, orbital dz2 berada pada sumbu X dimana ada lingkaran di tengah-tengahnya.
Gambar 5. Bentuk Orbital d (sumber: https://www.kimia-science7.com)
4) Orbital f Subkulit f memiliki 7 orbital yang memiliki tingkat energi yang setara. Bentuk orbitalnya lebih rumit dan sangat kompleks.
Gambar 6. Bentuk Orbital f (sumber: https://www.kimia-science7.com)
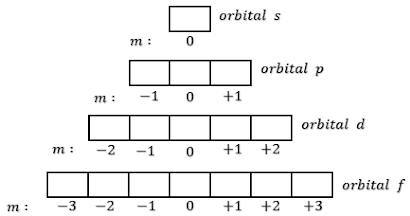
b. Diagram Orbital Diagram orbital digunakan untuk memudahkan penentuan nilai bilangan kuantum, yaitu bilangan kuantum magnetik dan bilangan kuantum spin. Diagram orbital akan dilambangkan dengan dengan kotak. Subkulit s = 1 kotak, subkulit p = 3 kotak, subkulit d = 5 kotak dan subkulit f = 7 kotak.
c. Penulisan konfigurasi Elektron
Penulisan konfigurasi elektron menurut model mekanika kuantum menggunakan diagram orbital dan perlu mengikuti aturan penentuan konfigurasi elektron berdasarkan orbital yang meliputi asas Aufbau, Larangan Pauli, dan Kaidah Hund.
Kedudukan elektron terluar dari suatu atom bisa ditentukan dengan melihat bilangan kuantumnya.
1) Asas Aufbau
Pengisian elektron dimulai dari subkulit yang memiliki tingkat energi paling rendah dilanjutkan pada subkulit yang lebih tinggi tingkat energinya. Dalam setiap sub kulit mempunyai batasan elektron yang dapat diisikan yakni: Subkulit s memiliki 1 orbital maksimal berisi 2 elektron Subkulit p memiliki 3 orbital maksimal berisi 6 elektron Subkulit d memiliki 5 orbital maksimal berisi 10 elektron Subkulit f memiliki 7 orbital maksimal berisi 14 elektron Urutan penulisan konfigurasi adalah sebagai berikut :
Gambar 7 Pengisian Elektron Berdasarkan Aturan Aufbau (Sumber: http://jusliandi0307.blogspot.com)
Anak panah menunjukkan urutan pengisian elektron pada model mekanika kuantum. Pengisian pertama diawali oleh 1s2 dan urutan paling akhir oleh 7s2
2. Urutan pengisian elektron pada konfigurasi elektron mekanika kuantum lebih lengkapnya adalah 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6 , 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6, 7s2 dan seterusnya. Jika kesulitan menghafal urutan ini, kalian sebenarnya tidak perlu menghafalkan urutan pengisian elektron ini. Kalian cukup lihat dari model pengisian elektron yang diberikan pada gambar di atas
Contoh :
Nitrogen (N), nomor atom N = 7 maka konfigurasi elektron sebagai berikut:
7N = 1s2 2s2 2p3
Neon (Ne), nomor atom Ne = 10 maka konfigurasi elektron sebagai berikut:
10Ne = 1s2 2s2 2p6
Magnesium (Mg), nomor atom Mg = 12 maka konfigurasi elektron sebagai berikut:
12Mg = 1s2 2s2 2p6 3s2
Klorin (Cl) nomor atom Cl = 17 maka konfigurasi elektron sebagai berikut:
17Cl = 1s2 2s2 2p6 3s2 3p5
Sedangkan untuk ion Cl– konfigurasinya:
17Cl– = 1s2 2s2 2p6 3s2 3p5
Kalsium (Ca) dengan nomor atom Ca = 20 maka konfigurasi elektronnya:
20Ca = 1s2 2s2 2p6 3s2 3p6 4s2
Sedangkan konfigurasi untuk ion Ca2+ sebagai berikut:
20Ca2+ = 1s2 2s2 2p6 3s2 3p6
2) Asas larangan Pauli
Tidak ada dua elektron dalam satu atom yang memiliki keempat bilangan kuantum yang sama. Setiap orbital maksimum diisi oleh 2 elektron yang memiliki spin yang berlawanan. Oleh karena dapat terjadi kemungkinan 2 elektron akan memiliki 3 bilangan kuantum n, l, dan m sama, tetapi untuk bilangan kuantum s pasti berbeda.
3) Kaidah Hund
Jika ada orbital dengan tingkat energi yang sama, konfigurasi elektron dengan energi terendah adalah dengan jumlah elektron tak berpasangan dengan spin paralel yang paling banyak.
Gambar 8 Konfigurasi Elektron dan Diagram Orbital (sumber: https://www.studiobelajar.com)
4) Aturan Setengah Penuh
Aturan konfigurasi elektron penuh-setengah penuh terjadi pada atom dengan golongan B yaitu pada pengisian elektron pada subkulit d. Elektron yang berisi penuh d10 dan setengah penuh d5 akan relatif lebih stabil. Sehingga, elektron cenderung akan mengisi orbital secara penuh atau setengah penuh. Perhatikan contoh berikut:
24Cr = 1s2 2s2 2p6 3s2 3p6 4s2 3d4 → Tidak stabil
24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5 → Stabil , karena mengikuti aturan setengah penuh
Dari contoh terlihat apabila atom 24Cr membentuk konfigurasi elektron 4s1 3d5 maka atom Cr leih stabil. Maka konfigurasi electron yang tepat adalah 1s2 2s2 2p6 3s2 3p6 4s1 3d5 . Hal ini juga berlaku untuk kasus:
29Cu = 1s2 2s2 2p6 3s2 3p6 4s2 3d9 → Tidak stabil
29Cu = 1s2 2s2 2p6 3s2 3p6 4s1 3d10 → Stabil , karena mengikuti aturan penuh
d. Bilangan Kuantum
Dalam konfigurasi elektron model mekanika kuantum dikenal empat bilangan kuantum. Bilangan kuantum tersebut yang menjelaskan letak elektron–elektron suatu atom. Keempat bilangan kuantum tersebut adalah bilangan kuantum utama (n), azimuth (l), magnetik (m), dan spin (s).
1) Bilangan Kuantum Utama (n)
Menyatakan tingkat energi utama dengan nilai n = 1, 2, 3, 4, 5, 6, dan 7.
n = 1 menyatakakan kulit pertama (K)
n = 2 menyatakakan kulit pertama (L)
n = 3 menyatakakan kulit pertama (M) dan seterusnya
2) Bilangan kuantum Azimuth (l)
Menyatakan bentuk orbital tempat elektron berada pada subkulit. Nilai bilangan azimut dimulai dari l = 0, 1, 2, 3, dan seterusnya.
Nilai l = 0 menyatakan subkulit s
Nilai l = 1 menyatakan subkulit p
Nilai l = 2 menyatakan subkulit d
Nilai l = 3 menyatakan subkulit f
3) Bilangan Kuantum Magnetik (m)
Menyatakan letak elektron pada suatu orbital. Nilai bilangan kuantum m adalah – l sampai dengan +l Untuk l = 0, subkulit s, m = 0 (terdapat 1 orbital)
Untuk l = 1, subkulit p, m = – 1, 0, + 1 (terdapat 3 orbital)
Untuk l = 2, subkulit d, m = –2, – 1, 0, + 1, +2 (terdapat 5 orbital)
Untuk l = 3, subkulit f, m = –3, –2, – 1, 0, + 1, +2, + 3 (terdapat 7 orbital)
4) Bilangan Kuantum Spin (s)
Menyatakan arah perputaran elektron. Nilai bilangan kuantum s adalah – ½ dan + ½ . s = + ½ menyatakan arah putaran searah jarum jam dan digambarkan dengan tanda panah ke atas.
s = – ½ menyatakan arah putaran berlawanan arah jarum jam digambarkan dengan tanda panah ke arah bawah.
Contoh bilangan kuantum untuk elektron terakhir pada:
e. Konfigurasi Elektron Gas Mulia
Gas mulia adalah unsur-unsur yang memiliki kestabilan yang sangat tinggi dan dalam sistem periodik terdapat pada golongan VIIIA.
Gas mulia terdiri dari He (Helium), Ne (Neon), Ar (Argon), Kr (Kripton), Xe (Xenon), Rn (Radon). Sebagian unsur ini ditemukan di alam sebagai unsur monoatomik. Hal penting yang menyebabkan gas mulia memiliki kesatabilan yang sangat tinggi adalah konfigurasi elektronnya.
Berikut ini adalah konfigurasi elektron dari unsur gas mulia:
2He = 1s2
10Ne = 1s2 2s2 2p6
18Ar = 1s2 2s2 2p6 3s2 3p6
36Kr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
86Rn = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
Konfigurasi elektron gas mulia digunakan untuk menyederhanakan atau meringkas penulisan konfigurasi elektron unsur yang lain. Misalnya, penulisan elektron unsur 21Sc, penulisannya sebagai berikut: 1s2 2s2 2p6 3s2 3p6 4s2 3d1 jika disederhanakan maka menjadi 21Sc = [Ar] 4s2 3d1
Letak Unsur dalam Sistem Periodik Unsur
Pada Pembelajaran satu kalian sudah mempelajari konfigurasi elektron. Tahukah kalian hubungan konfigurasi elektron dengan sistem periodik unsur? Hungannnya adalah letak suatu unsur dalam tabel sistem periodik unsur dapat ditentukan berdasarkan konfigurasi elektronnya. Bagaimanakah caranya? berikut akan kita pelajari bagaimana cara menentukan letak unsur dalam sistem periodik dengan menggunakan konfigurasi elektronnya.
Periode dan Golongan
Unsur-unsur yang jumlah kulitnya sama terletak pada periode (baris) yang sama.
nomor periode = kulit atom terbesar
Unsur-unsur yang struktur elektron terluarnya sama terletak pada golongan (kolom) yang sama.
Untuk menentukan nomor golongan, unsur-unsur dibagi menjadi tiga kelompok:
a. Unsur-unsur Utama (Golongan A)
Unsur-unsur yang pengisian elektronnya berakhir pada subkulit s (blok s) atau subkulit p (blok p).
nsx atau nsx npy
n = periode,
nomor golongan (blok s) = x atau nomor golongan (blok p) = x + y
Agar lebih paham, perhatikan tabel berikut:
Tabel Penentuan Golongan Utama (A)
Golongan | Nama Golongan | Elektron valensi | Blok | Penentu golongan | |
Versi Amerika | Versi IUPAC | ||||
IA/ 1A | 1 | Alkali | ns1 | s | s |
IIA/ 2A | 2 | Alkali Tanah | ns2 | s | s |
IIIA/ 3A | 13 | Boron | ns2 np1 | p | s + p |
IVA/ 4A | 14 | Karbon | ns2 np2 | p | s + p |
VA/ 5A | 15 | Nitrogen | ns2 np3 | p | s + p |
VIA/ 6A | 16 | Oksigen | ns2 np4 | p | s + p |
VIIA/ 7A | 17 | Halogen | ns2 np5 | p | s + p |
VIIIA/ 8A | 18 | Gas Mulia | ns2 np6 | p | s + p |
Perkecualian:
1H [ 1s1]: hidrogen tidak mempunyai golongan
2He [1s2]: helium termasuk gas mulia (VIIIA)
b. Unsur-unsur Transisi (Golongan B)
Unsur-unsur yang pengisian elektronnya berakhir pada sub kulit d.
Golongan = nsx (n - 1)dz
n = periode
x + z = nomor golongan
Perkecualian:
Jika x + z = 9 golongan VIIIB
jika x + z = 10 golongan VIIIB
jika x + z = 11 golongan IB
jika x + z = 12 golongan I IB
Agar lebih paham, perhatikan tabel berikut:
Tabel Penentuan Golongan Utama (B)
Golongan | Elektron valensi | Blok | Penentu Golongan | |
Versi Amerika | Versi IUPAC | |||
IIIB | 3 | (n – 1 )d1 ns2 | d | s + d |
IVB | 4 | (n – 1 )d2 ns2 | d | s + d |
VB | 5 | (n – 1 )d3 ns2 | d | s + d |
VIB | 6 | (n – 1 )d5 ns1 | d | s + d |
VIIB | 7 | (n – 1 )d5 ns2 | d | s + d |
VIIIB | 8 | (n – 1 )d6 ns2 | d | s + d |
VIIIB | 9 | (n – 1 )d7 ns2 | d | s + d |
VIIIB | 10 | (n – 1 )d8 ns2 | d | s + d |
IB | 11 | (n – 1 )d10 ns1 | d | s + d |
IIB | 12 | (n – 1 )d10 ns2 | d | s + d |
C. Unsur-unsurTransisi Dalam
Unsur-unsur yang pengisian elektronnya berakhir
pada subkulit f.
1) unsur-unsur Lantanida berakhir pada 4f.
2) unsur-unsur Aktinida berakhir pada 5f.

Contohnya
Pada atom 13Al, maka konfigurasi elektronnya:
13Al : 1s2 2s2 2p6 3s2 3p1
Diakhiri pada subkulit p yang artinya terletak pada Unsur Utama (A). Maka:
periode = 3
golongan : 2 + 1 = IIIA atau 13
Pada atom 21Sc, maka konfigurasi elektronnya:
21Sc : 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Diakhiri pada subkulit d yang artinya terletak pada Unsur Transisi (B). Maka:
periode = 4
golongan : 2 + 1 = IIIB atau 3










Komentar
Posting Komentar