Contoh soal hidrolisis garam
Mata Pelajaran : Kimia
Kelas : XI IPA 2
Kode KD : 3.11 Menganalisis kesetimbangan ion dalam larutan garam dan menghubungkan pH-nya
4.11 Melaporkan percobaan tentang sifat asam basa berbagai larutan garam
Materi Pembelajaran : Hidrolisis Garam
Sub MAteri : Hidrolisis Garam
Tujuan Pembelajaran :
Melalui model pembelajaran discovery learning diharapkan peserta didik mampu menganalisis garam yang terhidrolisis sempurna dalam air, menganalisis sifat garam yang terhidrolisis dalam air berdasarkan kekuatan asam dan basa penyusunnya serta menghitung pH larutan garam yang terhidrolisis dengan penuh rasa ingin tahu, tanggung jawab, displin selama proses pembelajaran, bersikap jujur, percaya diri dan pantang menyerah, serta memiliki sikap responsif (berpikir kritis) dan proaktif (kreatif), serta mampu berkomukasi dan bekerjasama dengan baik.dengan mengembangkan nilai karakter berpikir kritis , kreatif (kemandirian), kerjasama (gotongroyong) dan kejujuran (integritas) .
Assalamualaikum Wr WB
LATIHAN SOAL-SOAL
1. pH dari larutan garam NH4CN 0,2M. Diketahui Ka HCN = 4,0 x 10-10 mol/L, Kb NH3 = 1,8 x 10-5 mol/L adalah …..
a. 8,287
b. 8,227
c. 8,872
d. 8,827
Pembahasan
2. Jika suatu asam kuat dicampur dengan basa lemah, maka akan terbentuk larutan garam yang bersifat . . . .
a. Asam jika Ka > Kb
b. Basa jika Ka < Kb
c. Netral
d. Asam
Pembahasan
Sifat larutan garam yang terhidrolisis dapat dikelompokan berdasarkan jenis asam dan basa pembentuknya :
- Garam dari asam kuat dan basa lemah terhidrolisis mebentuk larutan garam yang bersifat asam (pH < 7)
- Garam dari asam lemah dan basa kuat terhidrolisis mebentuk larutan garam yang bersifat basa (pH > 7)
- Garam dari asam lemah dan basa lemah terhidrolisis membentuk larutan garam yang dapat bersifat asam, basa, atau netral.
- Larutan garam bersifat asam (pH < 7 ) jika Ka > Kb
- Larutan garam bersifat basa (pH > 7 ) jika Ka < Kb
- Larutan garam bersifat netral (pH = 7) jika Ka = Kb
Jawaban : D
3. Larutan garam yang berasal dari asam lemah dan basa lemah akan bersifat asam, jika . . . .
a. Ka > Kb
b. Ka < Kb
c. Kb > Ka
d. Ka = Kb
Pembahasan
Garam dari asam lemah dan basa lemah terhidrolisis membentuk larutan garam yang dapat bersifat asam, basa, atau netral.
- Larutan garam bersifat asam (pH < 7 ) jika Ka > Kb
- Larutan garam bersifat basa (pH > 7 ) jika Ka < Kb
- Larutan garam bersifat netral (pH = 7) jika Ka = Kb
Opsi A : Ka > Kb (Asam)
Opsi B : Ka < Kb (Basa)
Opsi C : Kb > Ka (Basa)
Opsi D : Ka = Kb (Netral)
Jawaban : A
4. pH dari larutan garam NH4Cl 0,2 M jika diketahui Kb NH3 = 1,8 x 10-5 mol/L adalah . . . .
a. 4,74
b. 4,82
c. 4,98
d. 5,26
Pembahasan
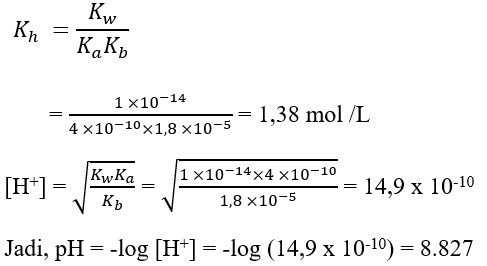

Komentar
Posting Komentar