tatanama senyawa organik dan anorganik
Nama : Desi Amalia, S.Pd
Mata Pelajaran : Kimia
Kelas : X IPA 1
Kode KD : 3.9. Mengidentifikasi reaksi reduksi dan oksidasi menggunakan konsep bilangan oksidasi unsur
Materi : Tatanama senyawa anorganik dan organik sederhana
Tujuan Pembelajaran : Melalui model pembelajaran dengan menggunakan Discovery Learning, peserta didik diharapkan mampu menjelaskan penerapan aturan tatanama senyawa anorganik sederhana menurut aturan IUPAC dan menentukan nama beberapa senyawa sesuai aturan IUPAC dengan penuh rasa ingin tahu, teliti dalam melakukan pengamatan dan bertanggung jawab, displin selama proses pembelajaran, bersikap jujur, percaya diri dan pantang menyerah, serta memiliki sikap responsif (berpikir kritis) dan proaktif (kreatif), serta mampu berkomukasi dan bekerjasama dengan baik.dengan mengembangkan nilai karakter berpikir kritis , kreatif (kemandirian), kerjasama (gotongroyong) dan kejujuran (integritas) .
Assalamualaikum Wr WB..
Halo semuanya anak-anak soleh solehah kelas X IPA 1
Bagaimana kabar nya hari ini nak? Semoga dalam keadaan sehat selalu ya..
Pesan ibu, tetap menjaga prokes nya dimana pun berada,, apalagi akhir-akhir ini sedang viral namanya virus covid terbaru yaitu, jenis omicron. Jadi pesan ibu kita semua harus tetap waspada.. jangan lupa jaga kebersihan..lindungi diri kalian , dan orang² disekitar kalian..
Minggu yang lalu kita telah mempelajari tentang " Cara menentukan oksidator maupun reduktor pada suatu reaksi redoks, serta menentukan reaksi autoredoks dan reaksi korproporsionasi " dan untuk hari ini kita mempelajari tentang mebuat tatanama senyawa anorganik maupun organik menurut aturan IUPAC.
Adapun langkah pembelajaran kita hari ini adalah :
- Isi presensi kehadiran terlebih dahulu di grup pjj WA.. ( waktu 5 menit )
- Buka blogger ibu, dan Silahkan pahami kompetensi dasar dan tujuan pembelajaran pada materi hari ini.
- Pahami materi dibawah ini, silahkan di simak baik-baik, lalu di catat dibuku catatan kalian masing-masing...
- Silahkan pahami video berikut ini : ( 20 menit menyimak dan mencatat materi nya )
. Baca dan pahami materi dibawah ini juga ya !
a. Penaman senyawa biner mengikuti urutan berikut : (
Bi – Si – As – C – P – N – H – S – I – Br – Cl – O – T
b. Tuliskan nama unsur logam tanpa modifikasi apa pun, kemudian diikuti nama unsur non logam dengan akhiran “ida”.
Contoh : NaCl = Natrium klorida ( Natrium termasuk unsur logam, Cl termasuk non logam ) sehingga penamaannya seperti diatas.
c. Unsur – unsur logam dengan bilangan oksidasi lebih dari satu jenis, maka bilangan oksidasinya ditulis dengan angka romawi.
Contoh : CrO = Kromium (II) oksida
2. Non Logam + Non Logam
a. Satu Jenis Senyawa
Cara penulisan rumus dan senyawanya yaitu dengan menuliskan terlebih dahulu unsur dengan bilangan oksidasi positif baru kemudian diikuti unsur dengan bilangan oksidasi negatif + ida.
Contoh : HCl = Hidrogen klorida
H2S = Hidrogen sulfida
b. Lebih dari Satu Jenis Senyawa
Cara penulisan rumus dan senyawanya yaitu dengan menuliskan terlebih dahulu unsur dengan bilangan oksidasi positif diikuti unsur dengan awalan mono / di / tri…../ deka dan akhiran “ida”.
Contoh : CO2 = Karbon dioksida
NO2 = Nitrogen dioksida
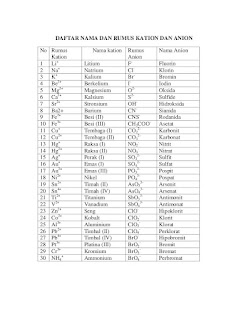
Tata Nama Senyawa Ion
Senyawa ion terdiri atas suatu kation dan suatu anion. Kation umumnya adalah ion logam sedangkan anion dapat berupa anion non logam. Berikut ini beberapa contoh senyawa ion.
Tata nama senyawa terner
Senyawa terner sederhana meliputi asam, basa, dan garam. Asam, basa, dan garam adalah tiga kelompok senyawa yang paling terkait satu dengan yang lain. Reaksi asam dengan basa menghasilkan garam.
1. Tata Nama Asam
Rumus asam terdiri atas atom hidrogen dan suatu anion yang di sebut sisa asam. Akan tetapi perlu diingat bahwa asam adalah senyawa molekul, bukan senyawa ion.
Contoh : H3PO4
Nama asam : asam fosfat
Rumus sisa asam : PO43-
2. Tata Nama Basa
Basa adalah zat yang didalam air dapat menghasilkan ion OH–. Pada umumnya basa adalah senyawa ion yang terdiri dari kation logam dan anion OH–. Nama basa sama dengan nama kationnya yang diikuti kata hidroksida.
Contoh : NaOH (Natrium Hidroksida)
Ca(OH)2 (Kalsium Hidroksida)
3. Tata Nama Garam
Garam adalah senyawa ion yang terdiri dari kation basa dan anion sisa asam. Rumus dan penamaannya sama dengan senyawa ion. Berikut tabel tata nama garam:
Demikianlah pembelajaran kita hari ini , semoga kalian selalu sehat dan tetap istiqomah dalam menjalankan ibadahnya... AAmiin..



Komentar
Posting Komentar