Perhitungan pH Larutan asam dan basa
Nama : Desi Amalia, S.Pd
Mata Pelajaran : Kimia
Kelas : XI IPA 3 dan 5
Kode KD : 3.10 Menjelaskan konsep Asam dan basa serta kekuatan nya dan kesetimbangan pengionan dalam larutan
Materi : Teori Asam Basa
Tujuan Pembelajaran : Melalui pembelajaran hari ini, diharapkan siswa/i dapat memahami dan menjelaskan kembali tentang menghitung konsentrasi ion H+ dan ION OH- dan dapat menghitung pH asam maupun basa suatu larutan.
Assalamualaikum Wr WB..
Halo semuanya anak-anak soleh solehah kelas XI IPA 3 dan 5.. Bagaimana kbrnya hari ini? Semoga sehat selalu untuk kita semua ya... Pesan ibu, tetap menjaga prokes nya dimana pun berada,, apalagi akhir-akhir ini sedang viral namanya virus covid terbaru yaitu, jenis omicron. Jadi pesan ibu kita semua harus tetap waspada.. jangan lupa jaga kebersihan..lindungi diri kalian , dan orang² disekitar kalian..
Minggu yang lalu kita telah mempelajari tentang menghitung konsentrasi ion H dan OH- , dan untuk pertemuan kali ini kita akan membahas bagaimana cara menghitung pH suatu larutan asam dan basa.
Menghitung pH dan pOH Dari Asam Basa Kuat
- Asam Sulfat (H2SO4)
- Asam Nitrat (HNO3)
- Asam Klorida (HCl)
- Asam Bromida (HBr)
- Asam Iodida (HI)
- Asam Perklorat (HClO4)
Asam Fluorida atau HF tidak termasuk ke dalam asam kuat karena ikatan antara atom Hidrogen dan Fluor cukup kuat disebabkan jari-jari atomnya yang kecil. Hal tersebut mengakibatkan HF sukar terionisasi di dalam air.
- NaOH
- KOH
- RbOH
- CsOH
- Ca(OH)2
- Ba(OH)2
Magnesium Hidroksida atau Mg(OH)2 tidak termasuk basa kuat karena mampu mengendap.


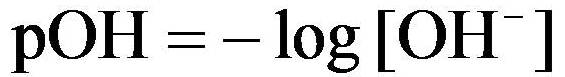

Contoh Soal Menghitung pH dan pOH dari Asam Kuat dan Basa Kuat + Pembahasan
Sebagai penilaian evaluasi hari ini, silahkan dikerjakan latihannya Halaman 195 No 10, no 11,12,13,14

Komentar
Posting Komentar