sel Volta
Materi : Sel Volta
Kelas : XII IPA 1
Jumlah Pertemuan : 1x Pertemuan ( 2 JP )
Tanggal : 6 Oktober 2020
Assalamualaikum Wr WB..
Bagaimana kabar nya anak-anak ku yang Soleh dan Solehah? Semoga selalu sehat wal'afiat dan dilindungi oleh ALLAH SWT ya...
Bagaimana dengan Hasil PTS nya kemarin? Sudah cukup memuaskan buat kalian? Semoga nilai² yang kalian peroleh, sesuai dengan harapan anak-anak semua ya..yang masih belum sesuai harapan nilai nya, lebih giat lagi belajar nya. Agar kemudian hari, nilai yang kalian peroleh itu sesuai dengan apa yang kalian harapkan.
Untuk pertemuan kita hari ini kita akan melanjutkan materi pembelajaran kita,masih berhubungan dengan sel Volta ya..
Kompetensi dasar :
3.4 menganalisis proses yang terjadi dan melakukan perhitungan listrik yang dapat terlibat pada suatu sel Volta,serta penerapannya dalam kehidupan.
4.4 merancang sel Volta dengan menggunakan bahan disekitar
Untuk materi hari ini sudah Bu Desi berikan penugasan dengan kalian , untuk mencari garis besar / point² yang terpenting yang ada di halaman 49-51,yaitu tentang sel Volta M(d bisa kalian cek buku cetak kalian masing-masing ) ,Bu Desi akan menanyakan langsung dengan kalian apa saja yang terkait dengan sel Volta.
Sewaktu PTS, Bu Desi telah memberikan soal tentang bagaimana menghitung potensial sel,, nah untuk kali ini Bu Desi ada sedikit pertanyaan. Prosedur kerja nya kalian isi jawaban kalian di komentar blogger ini ( sertakan Nama,kelas, dan Jawaban Kalian )
Sebelum masuk ke sesi pertanyaan, Bu Desi beri sedikit pendahuluan yaa, biar lebih mengingat lagi materi sebelumnya.
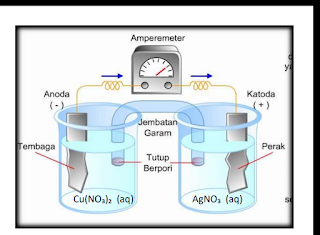
Sel Volta merupakan jenis sel Elektrokimia yang dapat menghasilkan energi listrik dari Reaksi Redoks yang berlangsung secara spontan. Berarti sel Volta itu proses perubahan nya terjadi dari perubahan kimia menjadi energi listrik dengan menggunakan Jembatan Garam.
Gambar diatas adalah Reaksi Redoks dalam sel Volta yang menggunakan Jembatan Garam.Untuk pertanyaan nya silahkan disimak :
1. Apa yang dimaksud dengan jembatan Garam ?
2. Jika kalian lihat pada gambar diatas terdapat perbedaan Antara ruang sebelah kiri dan kanan ( anode dan katode ) ,pertanyaan no 2 adalah katode bermuatan...dan anode bermuatan..
3. Elektrode terbagi menjadi dua,yaitu anode dan katode. Pertanyaan nya,apakah yang di maksud dengan elektrode?
4. Penulisan Reaksi kimia dalam sel Volta menggunakan ....., Tuliskan rumus penulisan nya...
Sekian pembelajaran yang bisa Bu Desi sampaikan hari ini, ingat jangan lupa kalian jawab di Koment blogger ini ( nama,kelas ,dan jawaban kalian ,tidak perlu tulis ulang soal 🤗 )
Boleh menggunakan buku cetak kalian, dalam membantu pengerjaan nya, jika ada kendala silahkan chat VIa WA. Jangan lupa solat 5 waktu nya jangan ditinggal ya anak2 Soleh Solehah semuanya..tetap semangat,,
Batas pengisian jawaban jam 9 malam..terimakasih..
Wassalamu'alaikum wr WB..
Nama:Feby Cahya Andini
BalasHapusKelas:12 IPA 1
1. Jembatan garam adalah suatu peralatan laboratorium yang digunakan untuk menghubungkan setengah sel reduksi dan oksidasi dari suatu sel galvani (sel volta).
2. Katode bermuatan positif, dan anode bermuatan negatif.
3. Eletrode adalah konduktor yang digunakan untuk bersentuhan dengan bagian atau media non logam dari sebuah sirkuit.
4. Menggunakan diagram sel. Reaksi di anode ditulis di sebelah kiri, sedangkan reaksi katode ditulis di sebelah kanan. (Anode|Larutan|Larutan|Katode). Rumusnya: E°Sel=E°Sel katode - E°Sel anode
Nama : Ega Berliana Putri Shavira
BalasHapusKelas : 12 IPA 1
💡JAWABAN💡
⚪1. Jembatan garam adalah alat penghubung reaksi setengah sel reduksi dan oksidasi pada sel volta. Jembatan garam merupakan tabung berbentuk U yang berisi garam NaNO3 ata KCl dalam gelatin / jel, berfungsi untuk mengalirkan elektron atau ion dari ruang katoda ke anoda sehingga menjadi rangkaian listrik tertutup.
⚪2. ↪️Katode : bermuatan positif [+]
↪️ Anode : bermuatan negatif [-]
⚪3. Elektrode adalah konduktor yang dilalui arus listrik dari satu media ke yang lain, biasanya dari sumber listrik ke perangkat atau bahan. Elektrode digunakan untuk bersentuhan dengan bagian atau media listrik non-logam dari sebuah sirkuit (seperti semi konduktor, elektrolit, atau vakum). Setiap elektrode dapat menjadi sebuah anode atau katode tergantung dari tegangan listrik yang diberikan ke sel elektrokimia tersebut.
⚪4. Penulisan Reaksi Kimia dalam sel volta yaitu menggunakan Diagram Sel.
▪️Rumus Penulisannya :
↪️ E⁰sel = E⁰ Katode - E⁰ Anode
{Anode|Larutan||Larutan|Katode}
Komentar ini telah dihapus oleh pengarang.
BalasHapusDella Andanniawati
BalasHapus12 ipa 1
1. Jembatan garan adalah komponen yang berfungsi untuk menjaga kenetralan muatan listrik pada larutan. Jembatan garam terdiri dari senyawa Na2SO4.
2. Katode bermuatan (+)
Anode bermuatan (-)
3. Pengertian elektrode
•Elektrode adalah penghantar listrik
yang menyerap dan melepaskan
elektron- elektron dari permukaannya.
•Logam seng dan tembaga yang
menjadi kutub -kutub pada rangkaian
sel elektrokimia disebut elektrode.
4. Rumus :
E°sel = E°Katode - E° Anode
Cara penulisan :
Anode|Larutan||Larutan|Katode|
Penulisannya menggunakan diagram sel
HapusNasywa Natasha Pambudi
BalasHapus12 IPA 1
.
1. Jembatan garam (atau tabung u) adalah alat yang digunakan untuk menghubungkan setengah sel reaksi reduksi dan reaksi oksidasi dari sel volta. Jembatan garam berisi garam dalam gelatin yang berfungsi menjaga kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus.
2. Katode bermuatan positif (+) dan Anode bermuatan negatif (–).
3. Elektrode adalah penghantar listrik (konduktor) yang digunakan untuk bersentuhan dengan media non logam agar dapat menyerap atau melepaskan elektron elektron. Kedua elektrode (katode dan anode) dihubungkan dengan voltmeter menggunakan kawat.
4. Penulisan reaksi kimia dalam sel volta menggunakan diagram sel. Reaksi di anode ditulis di kiri, sedangkan reaksi di katode ditulis di kanan.
Anode|Larutan||Larutan|Katode
E°sel = E°katode – E°anode
Nama :Eldest Saputra
BalasHapusKelas :12 IPA 1
1.Jembatan garam adalah gel yang berisi larutan garam seperti NaCl atau KCl yang digunakan untuk menyeimbangkan muatan pada larutan yang tereduksi maupun yang teroksidasi sehingga menyebabkan proses menghasilkan listrik suatu sel volta berlangsung lama.
2.Katode bermuatan positif (+) dan Anode bermuatan negatif (–).
3. Elektrode adalah penghantar listrik (konduktor) yang digunakan untuk bersentuhan dengan media non logam agar dapat menyerap atau melepaskan elektron elektron.
4.Penulisan Reaksi Kimia dalam sel volta yaitu menggunakan Diagram Sel.
▪️Rumus Penulisannya :
↪️ E⁰sel = E⁰ Katode - E⁰ Anode
{Anode|Larutan||Larutan|Katode}
Dafa Egitya Fadillah
BalasHapus12 IPA 1
1. Jembatan garam adalah alat yang digunakan untuk menghubungkan reaksi reduksi dan oksidasi setengah sel dari sel volta.
2. Katode bermuatan positif (+)
Anode bermuatan negatif ( - )
3. Elektrode adalah konduktor yang digunakan untuk bersentuhan dengan bagian atau media non-logam dari sebuah sirkuit.
4. Penulisan reaksi kimia dalam Sel Volta menggunakan Diagram Sel.
Rumus penulisan : reaksi di anode ditulis di sebelah kiri, sedangkan reaksi di katode di tulis di sebelah kanan.
Anode | Larutan || Larutan | Katode
Komentar ini telah dihapus oleh pengarang.
BalasHapusNama : Septy Meliza
BalasHapusKelas : 12 Ipa 1
1. Jembatan garam ( tabung yang berbentuk U) adalah suatu peralatan laboratorium yang digunakan untuk menghubungkan setengah-sel reduksi dan oksidasi dari suatu sel galvani (sel volta). Jembatan garam berfungsi menjaga kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus.
2.°Katode bermuatan positif(+)
° Anode bermuatan negatif ( - )
3. Elektrode adalah penghantar listrik (konduktor) yang digunakan untuk bersentuhan dengan media non logam agar dapat menyerap atau melepaskan elektron-elektron dari permukaannya.
Setiap elektrode dapat menjadi sebuah anode atau katode tergantung dari tegangan listrik yang diberikan kesel elektrokimia tersebut.
4. Penulisan reaksi kimia dalam sel volta menggunakan diagram sel. Reaksi di anode ditulis di sebelah kiri, sedangkan reaksi katode ditulis di sebelah kanan.
• Rumus penulisannya :
E°sel = E°katode – E°anode
Anode|Larutan||Larutan|Katode
Karovia Latifah
BalasHapus12 Ipa 1
1. Jembatan garam adalah suatu alat yang digunakan sebagai penghubung antara setengah sel reaksi reduksi dan reaksi oksidasi. Kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus itu karena fungsi dari jembatan garam berisi garam dalam gelatin.
2. Katode bermuatan positif(+)
Anode bermuatan negatif (-)
3. Elektrode adalah konduktor atau penghantar listrik yang digunakan untuk bersentuhan dengan media non logan agar dapat menyerap dan melepaskan elektron2. Jika bahan elektrode terbuat dari grafik (c) atau logam inert, elektrode tidak mengalami rekasi reduksi dan oksidasi.
Jadi, yang mengalami reduksi dan oksidasi adalah spesi-spesi yang ada di sekitar elektrode.
4. Penulisan reaksi kimia dalam sel Volta menggunakan diagram sel. Reaksi anode ditulis sebelah kiri dan reaksi katode ditulis sebelah kanan.
Anode|larutan||larutan|katode
(E°sel = E°katode - E°anode)
Muhammad Almas Fathur Rahman YuHa
BalasHapus12 IPA 1
1.jembatan garam adalah tabung U ysng mengandung larutan pelekat elektrolit insert seperti kalium klorida,nitrat,dan lainnya atau gelatin.berfungsi untuk mempertahankan kenetralan medium elektrolit tempat batang elektrode berada.
2.Katode bermuatan positif (+)
Anode bermuatan negatif ( - )
3.elektroda adalah konduktor yang dilalui arus listrik dari satu media ke lain untuk bersentuhan dengan bagian
bahan atau perangkat.elektroda di gunakan dalam pengelasan,listrik,baterai,obat,dan industri yang melibatkan elektrolisis.
4.Penulisan Reaksi Kimia dalam sel volta yaitu menggunakan Diagram Sel.
*Rumus Penulisannya:
E⁰sel = E⁰ Katode - E⁰ Anode
anode| larutan |larutan|
Katode
M.Adek Taufiqqurrohman
BalasHapus12 IPA 1
1. Jembatan garam adalah suatu peralatan laboratorium yang digunakan untuk menghubungkan setengah sel reduksi dan oksidasi dari suatu sel galvani (sel volta).
2. Katode bermuatan positif, dan anode bermuatan negatif.
3. Eletrode adalah konduktor yang digunakan untuk bersentuhan dengan bagian atau media non logam dari sebuah sirkuit.
4. Menggunakan diagram sel. Reaksi di anode ditulis di sebelah kiri, sedangkan reaksi katode ditulis di sebelah kanan. (Anode|Larutan|Larutan|Katode). Rumusnya: E°Sel=E°Sel katode - E°Sel anode
Rahmat aldo
BalasHapus12 IPA 1
1. Jembatan garam ialah alat yang digunakan untuk menghubungkan reaksi reduksi dan oksidasi setengah sel dari sel volta,jembatan garam ini berfungsi untuk menetralkan listrik dri kedua larutan
2. Katode bermuatan positif (+) Anode bermuatan negatif ( - )
3.Elektrode adalah konduktor (bahan penghantar panas) yang digunakan untuk bersentuhan dengan bagian yanh non-logam dari sebuah sirkuit.
4. Penulisan reaksi kimia dalam Sel Volta menggunakan Diagram Sel.
Rumus penulisan : reaksi di anode ditulis di sebelah kiri, sedangkan reaksi di katode di tulis di sebelah kanan.
Anode | Larutan || Larutan | Katode
Lucia Sabilla Haya
BalasHapus12 Ipa 1
1. Jembatan garam adalah suatu peralatan laboratorium yang digunakan untuk menghubungkan setengah-sel reduksi dan oksidasi dari suatu sel galvani (sel volta). Jembatan garam berfungsi menjaga kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus.
2. Katode bermuatan positif(+) dan Anode bermuatan negatif ( - )
3. Elektrode adalah penghantar listrik (konduktor) yang digunakan untuk bersentuhan dengan media non logam agar dapat menyerap atau melepaskan elektron-elektron dari permukaannya.
Setiap elektrode dapat menjadi sebuah anode atau katode tergantung dari tegangan listrik yang diberikan kesel elektrokimia tersebut.
4. Penulisan reaksi kimia dalam sel volta menggunakan diagram sel. Reaksi di anode ditulis di sebelah kiri, sedangkan reaksi katode ditulis di sebelah kanan.
🌸Rumus penulisannya :
E°sel = E°katode – E°anode
Anode|Larutan||Larutan|Katode
Mutia Cahyaningtyas
BalasHapus12 IPA 1
1. Jembatan garam adalah alat yang digunakan untuk menghubungkan setengah sel reaksi reduksi dan reaksi oksidasi dari sel volta. Jembatan garam berisi garam dalam gelatin yang berfungsi menjaga kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus.
2. Katode bermuatan positif (+) dan Anode bermuatan negatif (–).
3. Elektrode adalah konduktor (bahan penghantar panas) yang digunakan untuk bersentuhan dengan bagian yanh non-logam dari sebuah sirkuit.
4. Penulisan reaksi kimia dalam sel volta menggunakan diagram sel. Reaksi di anode ditulis di kiri, sedangkan reaksi di katode ditulis di kanan.
Anode|Larutan||Larutan|Katode
E°sel = E°katode – E°anode
Intan mahraja
BalasHapus12 IPA 1
1.jembatan garam adalah tabung U ysng mengandung larutan pelekat elektrolit insert seperti kalium klorida,nitrat,dan lainnya atau gelatin.berfungsi untuk mempertahankan kenetralan medium elektrolit tempat batang elektrode berada.
2.Katode bermuatan positif (+)
Anode bermuatan negatif ( - )
3.elektroda adalah konduktor yang dilalui arus listrik dari satu media ke lain untuk bersentuhan dengan bagian
bahan atau perangkat.elektroda di gunakan dalam pengelasan,listrik,baterai,obat,dan industri yang melibatkan elektrolisis.
4.Penulisan Reaksi Kimia dalam sel volta yaitu menggunakan Diagram Sel.
*Rumus Penulisannya:
E⁰sel = E⁰ Katode - E⁰ Anode
anode| larutan |larutan|
Katode
M.Ari Ginanjar
BalasHapus12 IPA 1
1. Jembatan garam adalah suatu alat yang digunakan sebagai penghubung antara setengah sel reaksi reduksi dan reaksi oksidasi. Kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus itu karena fungsi dari jembatan garam berisi garam dalam gelatin.
2. Katode bermuatan positif(+)
Anode bermuatan negatif (-)
3. Elektrode adalah konduktor atau penghantar listrik yang digunakan untuk bersentuhan dengan media non logan agar dapat menyerap dan melepaskan elektron2. Jika bahan elektrode terbuat dari grafik (c) atau logam inert, elektrode tidak mengalami rekasi reduksi dan oksidasi.
Jadi, yang mengalami reduksi dan oksidasi adalah spesi-spesi yang ada di sekitar elektrode.
4. Penulisan reaksi kimia dalam sel Volta menggunakan diagram sel. Reaksi anode ditulis sebelah kiri dan reaksi katode ditulis sebelah kanan.
Anode|larutan||larutan|katode
(E°sel = E°katode - E°anode)
Ajeng Suryani
BalasHapus12 IPA 1
⚪ Jembatan garam iyalah alat yang digunakan untuk menghubungkan reaksi reduksi dan oksidasi setengah sel dari sel volta,jembatan garam ini berfungsi untuk menetralkan listrik dri kedua larutan.
⚪ Katode bermuatan positif (+) Anode bermuatan negatif ( - )
⚪Elektrode adalah konduktor (bahan penghantar panas) yang digunakan untuk bersentuhan dengan bagian yanh non-logam dari sebuah sirkuit.
⚪ Penulisan reaksi kimia dalam Sel Volta menggunakan Diagram Sel.
Rumus penulisan :
reaksi di anode ditulis di sebelah kiri, sedangkan reaksi di katode di tulis di sebelah kanan.
⚪Anode | Larutan || Larutan | Katode
Gilang Ramadhan
BalasHapus12 IPA 1
1. Jembatan garam ( tabung yang berbentuk U) adalah suatu peralatan laboratorium yang digunakan untuk menghubungkan setengah-sel reduksi dan oksidasi dari suatu sel galvani (sel volta). Jembatan garam berfungsi menjaga kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus.
2.°Katode bermuatan positif(+)
° Anode bermuatan negatif ( - )
3. Elektrode adalah penghantar listrik (konduktor) yang digunakan untuk bersentuhan dengan media non logam agar dapat menyerap atau melepaskan elektron-elektron dari permukaannya.
Setiap elektrode dapat menjadi sebuah anode atau katode tergantung dari tegangan listrik yang diberikan kesel elektrokimia tersebut.
4. Penulisan reaksi kimia dalam sel volta menggunakan diagram sel. Reaksi di anode ditulis di sebelah kiri, sedangkan reaksi katode ditulis di sebelah kanan.
• Rumus penulisannya :
Anode | Larutan || Larutan | Katode
Revanza Satwika
BalasHapus12 IPA 1
1. Jembatan garam ialah suatu peralatan laboratorium yang digunakan untuk menghubungkan setengah sel reduksi dan oksidasi dari suatu sel galvani (sel volta).
2. Katode bermuatan positif, dan anode bermuatan negatif.
3. Eletrode adalah konduktor yang digunakan untuk bersentuhan dengan bagian atau media non logam dari sebuah sirkuit.
4. Menggunakan diagram sel. Reaksi di anode ditulis di sebelah kiri, sedangkan reaksi katode ditulis di sebelah kanan. (Anode|Larutan|Larutan|Katode). Rumusnya: E°Sel=E°Sel katode - E°Sel anode
Alvi khoirunnisa
BalasHapus12 IPA 1
1. Jembatan garam adalah suatu alat yang digunakan sebagai penghubung antara setengah sel reaksi reduksi dan reaksi oksidasi. Kenetralan listrik dari kedua larutan sehingga aliran listrik tidak terputus itu karena fungsi dari jembatan garam berisi garam dalam gelatin.
2. Katode bermuatan positif(+)
Anode bermuatan negatif (-)
3. Elektrode adalah konduktor atau penghantar listrik yang digunakan untuk bersentuhan dengan media non logan agar dapat menyerap dan melepaskan elektron2. Jika bahan elektrode terbuat dari grafik (c) atau logam inert, elektrode tidak mengalami rekasi reduksi dan oksidasi.
Jadi, yang mengalami reduksi dan oksidasi adalah spesi-spesi yang ada di sekitar elektrode.
4. Penulisan reaksi kimia dalam sel Volta menggunakan diagram sel. Reaksi anode ditulis sebelah kiri dan reaksi katode ditulis sebelah kanan.
Anode|larutan||larutan|katode
(E°sel = E°katode - E°anode)
1. Jembatan garam adalah suatu alat yg di gunakan sebagai penghubung antata setengah sel reaksi reduksi dan reaksi oksidasi.
BalasHapusKenetralan listrik dari kedua larutan sehingga aliran listrik tdk terputus itu karena fungsi dari jembatan garam berisi garam gelati
2. Katode bermuatan positif(+)
Anode bermuatan negatif(-)
3. Elektrode adalah konduktor yang digunakan untuk bersentuhan dengan bagian atau median non logam dari sebuah sirkuit misalnya ( semikonduktor , elektrolit , atau vakum )
4. Mengunakan diagram sel
Rumus=
E° Sel=E° Katode-E° Anode
{anode|larutan||larutan|katode}