menghitung pH larutan asam basa
Materi : Asam dan Basa
Kelas : XI ipa 5
Jumlah pertemuan : 2x pertemuan (4Jp )
Tanggal : 10 Februari 2020
Untuk menghitung nilai pH dan pOH dari asam kuat dapat dihitung dengan rumus berikut :


dimana [H+] dihitung dalam Molaritas (mol/liter larutan)
Untuk menghitung nilai pH dan pOH dari basa kuat dapat dihitung dengan rumus berikut :
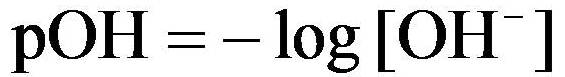

dimana [OH-] dihitung dalam Molaritas (mol/liter larutan)
Contoh Soal Menghitung pH dan pOH dari Asam Kuat dan Basa Kuat + Pembahasan
1. Hitunglah pH dan pOH dari 10 liter larutan H2SO4 0,02 M!

2. Hitunglah pH dan pOH dari 1 liter larutan Ca(OH)2 0,05 M!

3. Jika diketahui suatu asam kuat memiliki konsentrasi H+ sebesar 10-10 M, maka tentukan nilai pH larutan tersebut!

4. Suatu basa kuat diketahui memiliki konsentrasi OH- sebesar 10-9 M, tentukan nilai pH larutan tersebut!

Contoh Soal Larutan Campuran Asam Kuat dan Basa Kuat
1. Sebanyak 200 ml NaOH 1 M dicampurkan dengan 300 ml NaOH 0,05 M. Hitunglah pH larutan campuran!

2. Sebanyak 50 ml larutan KOH 0,2 N direaksikan dengan 50 ml larutan H2SO40,05 M. Tentukanlah pH larutan tersebut!

Menghitung pH dan pOH dari Asam Lemah dan Basa Lemah
Asam lemah dan basa lemah adalah asam dan basa yang tidak terionisasi secara sempurna di dalam air. Dengan demikian, asam lemah dan basa lemah termasuk elektrolit lemah.
Yang termasuk contoh asam lemah adalah :
- Asam Asetat (CH3COOH)
- Asam Format (HCOOH)
- Asam Oksalat (H2C2O4 · 2H2O)
- Asam Benzoat (C6H5COOH)
Adapun yang termasuk basa lemah adalah :
- Ammonium Hidroksida atau NH4OH
- Besi (II) Hidroksida atau Fe(OH)2
- Besi (III) Hidroksida atau Fe(OH)3
- Alumunium Hidroksida atau Al(OH)3
- Perak Hidroksida atau AgOH
Untuk menghitung pH dari asam lemah dapat digunakan rumus berikut :

dimana [H+] dihitung dalam Molaritas (mol/liter larutan)
Untuk menghitung pH dan pOH dari basa lemah dapat digunakan rumus berikut :

dimana [OH-] dihitung dalam Molaritas (mol/liter larutan)
Contoh Soal Menghitung pH Dan pOH dari Asam Lemah dan Basa Lemah + Pembahasan
1. Tentukan pH dari 555 ml Asam Etanoat 0,2 M dengan Ka = 1,8 x 10-5!

2. Jika diketahui suatu asam lemah berpH 5,5 dengan Ka = 2 x 10-5, tentukanlah konsentrasi asam tersebut dalam satuan Molaritas!

3. Tentukan pH dari 15 ml Ammonium Hidroksida 0,03 M dengan Kb = 1,8 x 10-5!

4. Suatu larutan basa lemah setelah dihitung pH nya dengan pH meter didapatkan hasil sebesar 10,5. Diketahui Kb basa tersebut adalah 3 x 10-5, tentukanlah konsentrasi basa tersebut dalam satuan Molaritas!


Komentar
Posting Komentar