Sifat fisik dan kimia pada alkana, alkena, dan alkuna
Sifat Fisik dan Kimia Alkana, Alkena, Alkuna, Senyawa Kimia - Berikut ini adalah materi lengkapnya :
1) Semua hidrokarbon merupakan senyawa nonpolar sehingga tidak larut dalam air. Jika suatu hidrokarbon bercampur dengan air, maka lapisan hidrokarbon selalu di atas sebab massa jenisnya lebih kecil daripada 1. Pelarut yang baik untuk hidrokarbon adalah pelarut nonpolar, seperti CCl4 atau atau sedikit polar (dietil eter atau benzena).
2) Alkana mudah larut dalam pelarut organik. [1]
Semakin bertambah jumlah atom C maka Mr ikut bertambah akibatnya titik didih dan titik leleh semakin tinggi. Alkana rantai lurus mempunyai titik didih lebih tinggi dibanding alkana rantai bercabang dengan jumlah atom C sama. Semakin banyak cabang, titik didih makin rendah. [1]
3) Pada suhu dan tekanan biasa, empat alkana yang pertama (CH4 sampai C4H10 berwujud gas. Pentana (C5H12) sampai heptadekana (C17H36) berwujud cair, sedangkan oktadekana (C18H38) dan seterusnya berwujud padat.
Alkana lebih ringan dari air. [2]
1) Alkana dan sikloalkana tidak reaktif, cukup stabil apabila dibandingkan dengan senyawa organik lainnya. Oleh karena kurang reaktif, alkana kadang disebut paraffin (berasal dari bahasa Latin: parum affins, yang artinya "afinitas kecil sekali"). [2]
2) Pembakaran/oksidasi alkana bersifat eksotermik (menghasilkan kalor). Pembakaran alkana berlangsung sempurna dan tidak sempurna. Pembakaran sempurna menghasilkan gas CO2 sedang pembakaran tidak sempurna menghasilkan gas CO. [1] Itulah sebabnya alkana digunakan sebagai bahan bakar. Secara rata-rata, oksidasi 1 gram alkana menghasilkan energi sebesar 50.000 joule.
Reaksi pembakaran sempurna :
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) + Energi
Reaksi pembakaran tak sempurna:
2 CH4(g) + 3 O2(g) → 2 CO(g) + 4 H2O(g) + Energi
3) Jika direaksikan dengan unsur-unsur halogen (F2, Cl2, Br2, dan I2), maka atom-atom H pada alkana mudah mengalami substitusi (penukaran) oleh atom-atom halogen.
CH4 + Cl2 → CH3Cl (metilklorida (klorometana)) + HCl
CH3Cl + Cl2 → CH2Cl2 (diklorometana) + HCl
CH2Cl2 + Cl2→ CHCl3 (kloroform (triklorometana)) + HCl
4)Senyawa alkana rantai panjang dapat mengalami reaksi eliminasi. Reaksi eliminasi adalah reaksi penghilangan atom/gugus atom untuk memperoleh senyawa karbon lebih sederhana. [1] Contoh pada reaksi eliminasi termal minyak bumi dan gas alam.
800 - 900 oC
| ||||
CH3 - CH2 - CH3
|
→
|
CH3 - CH = CH2 + H2
| ||
propana
|
propena
| |||
800 - 900 oC
| ||||
CH3 - CH2 - CH3
|
→
|
CH2 = CH2
|
+
|
CH4
|
propana
|
etena
|
metana
|
a. Sifat Fisik Alkena
1) Alkena memiliki sifat fisika yang sama dengan alkana. Perbedaannya yaitu, alkena sedikit larut dalam air. Hal ini disebabkan oleh adanya ikatan rangkap yang membentuk ikatan π. Ikatan π tersebut akan ditarik oleh hidrogen dari air yang bermuatan positif sebagian.
2) Titik leleh dan titik didih alkena hampir sama dengan alkana yang sesuai, makin bertambah jumlah atom C, harga Mr makin besar maka titik didihnya makin tinggi.
b. Sifat Kimia Alkena
1) Alkena memiliki sifat fisika yang sama dengan alkana. Perbedaannya yaitu, alkena sedikit larut dalam air. Hal ini disebabkan oleh adanya ikatan rangkap yang membentuk ikatan π. Ikatan π tersebut akan ditarik oleh hidrogen dari air yang bermuatan positif sebagian.
2) Titik leleh dan titik didih alkena hampir sama dengan alkana yang sesuai, makin bertambah jumlah atom C, harga Mr makin besar maka titik didihnya makin tinggi.
b. Sifat Kimia Alkena
Alkena jauh lebih reaktif daripada alkana karena adanya ikatan rangkap. Reaksi alkena terutama terjadi pada ikatan rangkap tersebut.
Reaksi-reaksi alkena sebagai berikut.
a) Reaksi Adisi (penambahan atau penjenuhan)
Reaksi adisi, yaitu pengubahan ikatan rangkap menjadi ikatan tunggal dengan cara mengikat atom lain.
Zat-zat yang dapat mengadisi alkena adalah :
(1) Gas hidrogen (H2)
Reaksi adisi merupakan reaksi pemutusan ikatan rangkap. Pada adisi alkena, ikatan rangkap berubah menjadi ikatan tunggal. [2]
a) CH2 = CH2 (etena) + H2 → CH3 – CH3(etana)
b) CH2 = CH – CH3 (propena) + H2 → CH3 – CH2 – CH3 (propana)
Reaksi-reaksi alkena sebagai berikut.
a) Reaksi Adisi (penambahan atau penjenuhan)
Reaksi adisi, yaitu pengubahan ikatan rangkap menjadi ikatan tunggal dengan cara mengikat atom lain.
Zat-zat yang dapat mengadisi alkena adalah :
(1) Gas hidrogen (H2)
Reaksi adisi merupakan reaksi pemutusan ikatan rangkap. Pada adisi alkena, ikatan rangkap berubah menjadi ikatan tunggal. [2]
a) CH2 = CH2 (etena) + H2 → CH3 – CH3(etana)
b) CH2 = CH – CH3 (propena) + H2 → CH3 – CH2 – CH3 (propana)
) Halogen (F2, Cl2, Br2, dan I2)
Reaksi adisi oleh halogen akan memutus rantai rangkap alkena membentuk alkana. Selanjutnya halogen tersebut akan menjadi cabang/substituen dari alkana yang terbentuk. [2]
a)
b)
(3) Asam halida (HCl, HBr, HF, dan HI)
Jika alkena menangkap asam halida berlaku aturan Markovnikov, yaitu atom H dari asam halida akan terikat
pada atom C berikatan rangkap yang telah memiliki atom H lebih banyak.
Jika atom C yang berikatan rangkap memiliki jumlah H yang sama, halida akan terikat pada atom C yang paling panjang. [2]
a)
b.
1) Sifat fisika alkuna sama dengan alkana dan alkena. Alkuna juga sedikit larut dalam air.
2) Titik didih alkuna mirip dengan alkana dan alkena. Semakin bertambah jumlah atom C harga Mr makin besar maka titik didihnya makin tinggi.
b. Sifat Kimia Alkuna
Reaksi- reaksi pada alkuna mirip dengan alkena, hanya berbeda pada kebutuhan jumlah pereaksi untuk penjenuhan ikatan rangkap.
Alkuna membutuhkan jumlah pereaksi dua kali kebutuhan pereaksi pada alkena untuk jumlah ikatan rangkap yang sama.
Contoh :
Reaksi penjenuhan etena oleh gas hidrogen
CH2 = CH2 (etena) + H2→ CH3 – CH3 (etana)
a) Oksidasi [2]
Sebagaimana hidrokarbon pada umumnya, alkuna jika dibakar sempurna akan menghasilkan CO2 dan H2O.
C3H4 + 4O2 → 3CO2 + 2H2O
b) Adisi H2 [2]
Alkuna mengalami dua kali adisi oleh H2 untuk menghasilkan alkana.
Contoh :
c) Adisi Halogen [2]
d) Adisi Asam halida [2]
Adisi alkuna oleh asam halida mengikuti aturan Markovnikov sebagaimana pada alkena.
Anda sekarang sudah mengetahui Sifat Fisik dan Kimia Alkana, Alkena, Alkuna.
Reaksi adisi oleh halogen akan memutus rantai rangkap alkena membentuk alkana. Selanjutnya halogen tersebut akan menjadi cabang/substituen dari alkana yang terbentuk. [2]
a)
b)
(3) Asam halida (HCl, HBr, HF, dan HI)
Jika alkena menangkap asam halida berlaku aturan Markovnikov, yaitu atom H dari asam halida akan terikat
pada atom C berikatan rangkap yang telah memiliki atom H lebih banyak.
Jika atom C yang berikatan rangkap memiliki jumlah H yang sama, halida akan terikat pada atom C yang paling panjang. [2]
a)
b.
Pada gambar di atas ikatan rangkap membagi sama banyak atom C dan atom H, sehingga simetris.
Pada gambar di atas ikatan rangkap tidak membagi sama banyak atom C dan atom H, sehingga tidak simetris.
Keterangan: H terikat pada atom C1 karena C1 mengikat 2 atom H dan C2 mengikat hanya 1 atom H. Sedangkan Br terikat pada atomC2.
Pada gambar di atas ikatan rangkap tidak membagi sama banyak atom C dan atom H, sehingga tidak simetris.
Keterangan: H terikat pada atom C1 karena C1 mengikat 2 atom H dan C2 mengikat hanya 1 atom H. Sedangkan Br terikat pada atomC2.
b) Reaksi Pembakaran (oksidasi dengan oksigen)
1) Pembakaran sempurna alkena menghasilkan CO2 dan H2O.
C2H4 + 3 O2 → 2 CO2 + 2 H2O
2) Pembakaran tidak sempurna alkena menghasilkan CO dan H2O.
C2H4 + 2 O2 → 2 CO + 2 H2O
c) Reaksi Polimerisasi
Reaksi polimerisasi adalah reaksi penggabungan molekul-molekul sederhana (monomer) menjadi molekul besar (polimer).
Contoh :
Polimerisasi etena menjadi polietena
n CH2 = CH2 → – CH2 – CH2– → [– CH2 – CH2–]n
3. Sifat Senyawa Alkuna
1) Pembakaran sempurna alkena menghasilkan CO2 dan H2O.
C2H4 + 3 O2 → 2 CO2 + 2 H2O
2) Pembakaran tidak sempurna alkena menghasilkan CO dan H2O.
C2H4 + 2 O2 → 2 CO + 2 H2O
c) Reaksi Polimerisasi
Reaksi polimerisasi adalah reaksi penggabungan molekul-molekul sederhana (monomer) menjadi molekul besar (polimer).
Contoh :
Polimerisasi etena menjadi polietena
n CH2 = CH2 → – CH2 – CH2– → [– CH2 – CH2–]n
3. Sifat Senyawa Alkuna
1) Sifat fisika alkuna sama dengan alkana dan alkena. Alkuna juga sedikit larut dalam air.
2) Titik didih alkuna mirip dengan alkana dan alkena. Semakin bertambah jumlah atom C harga Mr makin besar maka titik didihnya makin tinggi.
b. Sifat Kimia Alkuna
Reaksi- reaksi pada alkuna mirip dengan alkena, hanya berbeda pada kebutuhan jumlah pereaksi untuk penjenuhan ikatan rangkap.
Alkuna membutuhkan jumlah pereaksi dua kali kebutuhan pereaksi pada alkena untuk jumlah ikatan rangkap yang sama.
Contoh :
Reaksi penjenuhan etena oleh gas hidrogen
CH2 = CH2 (etena) + H2→ CH3 – CH3 (etana)
a) Oksidasi [2]
Sebagaimana hidrokarbon pada umumnya, alkuna jika dibakar sempurna akan menghasilkan CO2 dan H2O.
C3H4 + 4O2 → 3CO2 + 2H2O
b) Adisi H2 [2]
Alkuna mengalami dua kali adisi oleh H2 untuk menghasilkan alkana.
Contoh :
HC ≡ C – CH3
|
+
|
H2
|
→
|
H2C = CH – CH3
|
+
|
H2
|
→
|
H3C – CH2 – CH3
|
propuna
|
propena
|
propana
|
c) Adisi Halogen [2]
d) Adisi Asam halida [2]
Adisi alkuna oleh asam halida mengikuti aturan Markovnikov sebagaimana pada alkena.
Anda sekarang sudah mengetahui Sifat Fisik dan Kimia Alkana, Alkena, Alkuna.

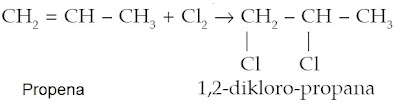
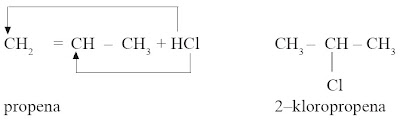
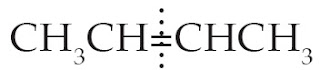
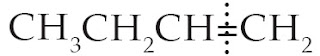
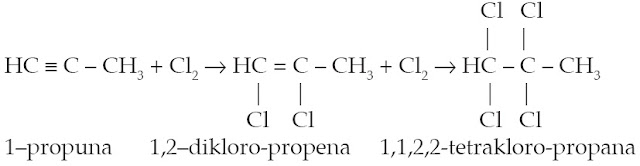

Komentar
Posting Komentar