Sifat Koligatif Larutan ( Diagram P-T )
1. NAMA GURU : DESI AMALIA, SPd
MATA PELAJARAN : KIMIA
3.
KELAS : XII IPA 4
4.
PERTEMUAN : ke 2
5.
KD : 3.1
6.
TUJUAN
PEMBELAJARAN :
7.
MATERI : Sifat Koligatif Larutan
8.
METODE
: Diskusi dan tanya jawab dengan pendekatan saintifik
9. STRATEGI :
1. 1. Guru menyampaikan KD dan Tujuan Pembelajaran
q 2. Guru memberikan apersepsi seperti ;
|
Mengaitkan
materi/tema/kegiatan pembelajaran yang akan dilakukan dengan pengalaman
peserta didik dengan materi/tema/kegiatan sebelumnya |
|
Mengingatkan
kembali materi prasyarat dengan bertanya. |
|
Mengajukan pertanyaan yang ada keterkaitannya dengan pelajaran yang akan dilakukan. |
|
Memberikan
gambaran tentang manfaat mempelajari pelajaran yang akan dipelajari dalam
kehidupan sehari-hari. |
||||
|
Apabila
materitema/projek ini kerjakan dengan
baik dan sungguh-sungguh ini dikuasai dengan baik, maka peserta didik
diharapkan dapat menjelaskan tentang materi : |
||||
|
Diagram
P-T 4. Guru meminta sswa untuk duduk sesuai kelompok yang telah dibagikan 5.
|
2.10. PENGEMBBANGAN MATERI :
B Bacalah artikel dibawah ini dan pahami lah video berikut ini...
BMelelehkan Salju dengan Garam
Di negara-negara dingin seperti Eropa, sering sekali terjadi salju saat musim dingin. Turunnya salju dapat menjadi masalah serius karena menggangu transportasi. Salju yang menutup jalan akan menyebabkan jalan menjadi sangat licin sehingga kendaraan menjadi mudah tergelincir.
Ternyata, untuk mencairkan salju dan es dapat dilakukan dengan cara menaburkan garam dapur dan/atau urea. Cara ini ditempuh karena untuk melakukan pemanasan sangat sulit dilakukan (kan udaranya dingin).
Kenapa garam dapat melelehkan salju?
Penambahan garam dapur akan menyebabkan titik beku air turun di bawah 0°C. Hal ini sesuai dengan salah satu sifat koligatif larutan, dimana jika kadar zat terlarut (dalam hal ini garam) dalam larutan (larutan garam-air) bertambah, larutan menjadi lebih sulit membeku.
Untuk dapat membeku, jarak antarmolekul dalam suatu substansi harus dirapatkan hingga tidak dimungkinkan adanya perpindahan tempat dari molekul-molekul tersebut. Semakin dingin suhu, pergerakan molekul makin berkurang sehingga kemungkinan molekul menjadi rapat satu sama lain semakin besar.
Adanya partikel-partikel zat terlarut (garam) akan mengakibatkan proses pergerakan molekul-molekul pelarut (air) terhalang. Akibatnya, untuk dapat lebih mendekatkan jarak antarmolekul sejenis diperlukan suhu yang lebih rendah dari normal. Jadi, titik beku larutan akan lebih rendah daripada titik beku pelarut murninya (air).
Air murni akan membeku pada suhu 0°C, sehingga bila suhu udara mencapai 0°C, air hujan akan berubah menjadi salju. Misalnya dengan penambahan sejumlah garam titik beku air menjadi -2°C, maka pada suhu lingkungan 0°C salju yang ada di jalanan akan segera mencair.
Secara keseluruhan, semakin banyak zat terlarut, semakin besar sifat koligatifnya. Sifat koligatif hanya memperhatikan kuantitas bukan kualitas. Sifat-sifat larutan seperti warna, kekentalan (viskositas), dan konduktivitas listrik adalah sifat-sifat yang tergantung pada jenis zat terlarut.
Agar lebih jelas mengenai sifat koligatif larutan, simak dan pahami lah diagram P-T berikut ini !
- Pengeringan dan pembentukan garam pada lautan mati.
- Pembuatan kolam renang apung.
- Mendapatkan benzena murni
- 2. Penerapan Sifat Koligatif Larutan Kenaikan Titik Didih
- Penyulingan minyak bumi.
- Penggunaan panci presto.
- Distilasi
- Penyulingan gula
- Penambahan bumbu setelah air mendidih saat memasak.
- Penambahan garam saat memasak.
- Pengukuran massa molar.
- Mencairkan salju dengan garam.
- 3. Penerapan Sifat Koligatif Larutan Penurunan Titik Beku
- Mencairkan salju dengan garam dapur
- Pembuatan es krim.
- Penambahan etilen glikol pada radiator mobil.
- Membuat es putar menggunakan dapur.
- Penggunaan zat anti beku pada minyak kelapa.
- Penggunaan zat anti beku pada tubuh hewan.
- 4. Penerapan Sifat Koligatif Larutan Tekanan Osmosis
- Transportasi air tanah melalui akar ke seluruh bagian tanaman.
- Penggunaan garam dapur untuk membunuh lintah.
- Pengawetan makanan dengan garam dapur.
- Proses yang terjadi di dalam mesin cuci.
- Penggunaan larutan tetes mata pada mata.
- Pemisahan zat beracun dalam air limbah.
- Penggunaan larutan infus melalui pembuluh darah.
- Pembuatan ikan asin.
- Desalinasi air laut (osmosis balik).
CONTOH SOAL DAN PEMBAHASAN :
1. Sifat koligatif larutan adalah sifat yang bergantung pada ….
a. Jenis zat terlarut
b. Jenis zat pelaut
c. Jumlah zat pelarut
d. Jumlah zat terlarut
e. Konsentrasi larutan
Jawaban : D
Pembahasan
Sifat koligatif larutan adalah sifat-sifat yang hanya tergantung pada Jumlah (kuantitas) partikel zat terlarut dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat terlarut, tidak peduli dalam bentuk atom, ion, ataupun molekul. Sifat koligatif merupakan sifat yang hanya memandang “kuantitas” bukan “kualitas”.
2. Salah satu yang akan di sebebkan oleh keberadaan zat terlarut dalam pelarut adalah ….
a. Tekanan uap jenuh lebih tinggi daripada tekanan uap jenuh pelarut
b. Titik beku larutan lebih tinggi daripada titik beku pelarut
c. Tekanan osmosis larutan lebih rendah dari tekanan osmosis pelarut
d. Titik didih larutan lebih tinggi daripada titik didih pelarut
e. Titik didih pelarut lebih tinggi dari pelarutnya
Jawaban : D
Pembahasan
Keberadaan zat terlarut dalam pelarut dapat mengakibatkan terjadinya kenaikan titik didih larutan, karena terjadinya penurunan tekanan uap larutan oleh keberadaan zat terlarut tersebut. Sehingga dibutuhkan kenaikan temperatur untuk menaikkan tekanan uap larutan sehingga sama dengan tekanan eksternal.
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
Jawaban : C
Pembahasan
Fraksi mol larutan methanol CH3OH dalam air adalah 0,50. Kosentrasi methanol dalam arutanini dinyataan dalam persen berat methanol adalah …. Ar C = 12, O = 16, H =1
a. 64 %
b. 54%
c. 63%
d. 62%
e. 60%
Jawaban : A
Pembahasan :
5. Jika didalam suatu larutan yang dibuat dengan melarutkan 4,5 gram glukosa (C6H12O6) dalam 100 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,4 molal
c. 0,3 molal
d. 0,5 molal
e. 0,43 molal
Jawaban : A
Pembahasan
Latihan soal :
1. jika suatu larutan mengandung 24 gram MgSO4 dilarutkan dalam 500 gram air.. molalitasnya adalah ….(Mr MgSO4 = 120)
a. 0,5 molal
b. 0,7 molal
c. 0,6 molal
d. 0,4 molal
e. 0,9 molal
2. Didalam suatu larutan yang telah dibuat dari 5 gram kristal NaOH yang dilarutkan ke dalam air hingga volumenya 500 mL, konsentrasinya adalah …. (Mr NaOH = 40)
a. 0,1 mol/L
b. 0,5 mol/L
c. 0,25 mol/L
d. 0,7 mol/L
e. 0,35 mol/L
3. Jika didalam zat terlarut dan zat pelarut ada 200 gram air dan dilarutkan 30 gram asam cuka (CH3COOH) fraksi molnya zat terlarut adalah (Ar C = 12, H= 1, O = 16) ….
a. 0,943
b. 0,957
c. 0,987
d. 0,945
e. 0,975
4. Jika didalam suatu larutan yang dibuat dengan melarutkan 5,5 gram glukosa (C6H12O6) dalam 200 gram air,kemolalanya adalah …. (Ar C = 12, H =1, O = 16)
a. 0,25 molal
b. 0,14 molal
c. 0,35 molal
d. 0,05 molal
e. 0,15 molal

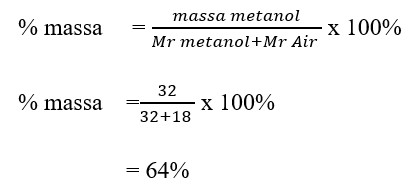
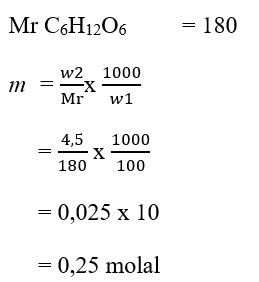

Komentar
Posting Komentar